早教吧作业答案频道 -->化学-->
为了探究HClO的漂白性,某同学设计了如下的实验:(1)通入Cl2后,集气瓶B中发生反应的化学方程式是,通过实验现象得出的结论为.(2)为了确证是HClO起漂白作用,你认为还应增加
题目详情
为了探究HClO的漂白性,某同学设计了如下的实验:
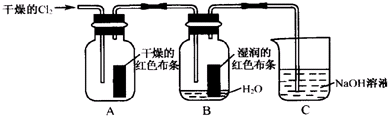
(1)通入Cl2后,集气瓶B中发生反应的化学方程式是___,通过实验现象得出的结论为___.
(2)为了确证是HClO起漂白作用,你认为还应增加的实验是___.
(3)烧杯C中盛有NaOH溶液,其作用是___.
(4)为保证实验安全,当氯气以平均每分钟1.12L(标准状况)的流速通入时,若实验需耗时4分钟,则小烧杯中至少需盛有2mol•L-1NaOH溶液的体积是多少?(写出计算过程)

(1)通入Cl2后,集气瓶B中发生反应的化学方程式是___,通过实验现象得出的结论为___.
(2)为了确证是HClO起漂白作用,你认为还应增加的实验是___.
(3)烧杯C中盛有NaOH溶液,其作用是___.
(4)为保证实验安全,当氯气以平均每分钟1.12L(标准状况)的流速通入时,若实验需耗时4分钟,则小烧杯中至少需盛有2mol•L-1NaOH溶液的体积是多少?(写出计算过程)
▼优质解答
答案和解析
(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;干燥的氯气没有漂白性,湿润的氯气具有漂白性;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,
故答案为:稀盐酸是否能使有色布条褪色;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气(尾气),防止氯气污染空气;
(4)实验需耗时4分钟通入氯气的物质的量为:n(Cl2)=
=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=
=0.2L=200mL,
答:至少需盛200mlL 2mol•L-1的氢氧化钠溶液.
故答案为:Cl2+H2O=HCl+HClO;干燥的氯气没有漂白性,湿润的氯气具有漂白性;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,
故答案为:稀盐酸是否能使有色布条褪色;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气(尾气),防止氯气污染空气;
(4)实验需耗时4分钟通入氯气的物质的量为:n(Cl2)=
| 1.12L×4 |
| 22.4L/mol |
需要n(NaOH)=0.4mol,
所以V(NaOH)=
| 0.4mol |
| 2mol/L |
答:至少需盛200mlL 2mol•L-1的氢氧化钠溶液.
看了为了探究HClO的漂白性,某同...的网友还看了以下:
碳酸氢钠的热稳定性实验的检验气密性碳酸氢钠的热稳定性实验中,检验气密性是在放了药品之后安在铁架台上 2020-04-26 …
实验室按如图所示装置制取CO2,并检验CO2的性质,试回答以下问题:(1)用装置A来制取二氧化碳, 2020-05-13 …
将制得的二氧化碳气体依次通过右下图所示的装置,写出A、B两装置中可观察到的实验现象和得出的结论.A 2020-05-13 …
(2007•白下区二模)实验室用下图装置制取二氧化碳,并检验它的性质.回答下列问题:(1)若用装置 2020-05-13 …
甲和乙为一对相对性状,用以进行杂交实验可以得到下列四组实验结果.若甲性状为显性,用来说明试验中甲性 2020-05-16 …
法所具有的规定人们行为的模式,引导人们行为的性质的特征是指( )。A.法的普遍性B.法的一般性C.法 2020-05-18 …
从行为的性质上看,限制竞争行为是一种( )。 A. 反竞争行为 B. 技术性竞争行为 C. 不正当竞 2020-05-19 …
对于明知故犯者,应讲清道理,指出错误之处,并根据其违法行为的性质、危害程度,确定是否报 2020-05-20 …
国家保险监管机构进行保险监督管理行为的性质属于( )。 2020-05-22 …
根据行为的性质及其后果,人类行为的类型包括()。A.利他主义行为B.反社会行为C.攻击性行为D.助人 2020-06-04 …