早教吧作业答案频道 -->化学-->
“寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.提出问题锌与稀硫酸反应的快慢受哪些因素的影响呢?猜想与假设a可能与硫酸的质量分数有关;b可能与锌
题目详情
“寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a可能与硫酸的质量分数有关;b可能与锌的形状有关.
【设计并实验】小兵用不同质量分数的稀硫酸和不同形状的锌进行如下实验.
(1)写出稀硫酸与锌反应的化学方程式___.
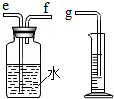
(2)小兵用如图所示装置收集并测量氢气的体积,其中量筒的作用是___,氢气应从___(填e或f或g)管通入;
【收集证据】(3)把数据罗列表中,据表分析
【得出结论】(4)结论是___.(说一条)
【评价与反思】(5)如表是小兵第①组实验的详细数据.
请描述锌与硫酸反应的快慢的变化并解释原因___.
(6)锌与硫酸反应的快慢可能还受哪些因素影响?___(与(7)方案不同)设计实验验证:___.
(7)探究影响锌与稀硫酸反应快慢的因素,反应过程中,用将10min内收集的氢气体积比较反应的快慢,控制其他条件相同,进行下表四组实验,获得数据如下表.
①比较实验a和实验b,可以得到的结论是___.
②取13g含杂质的锌进行实验b,得到的氢气为2000mL,则该种锌的质量百分数___(该条件下,氢气的密度约为0.1克/升)
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a可能与硫酸的质量分数有关;b可能与锌的形状有关.
【设计并实验】小兵用不同质量分数的稀硫酸和不同形状的锌进行如下实验.
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(2)小兵用如图所示装置收集并测量氢气的体积,其中量筒的作用是___,氢气应从___(填e或f或g)管通入;
【收集证据】(3)把数据罗列表中,据表分析
【得出结论】(4)结论是___.(说一条)
【评价与反思】(5)如表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
(6)锌与硫酸反应的快慢可能还受哪些因素影响?___(与(7)方案不同)设计实验验证:___.
(7)探究影响锌与稀硫酸反应快慢的因素,反应过程中,用将10min内收集的氢气体积比较反应的快慢,控制其他条件相同,进行下表四组实验,获得数据如下表.
| 实验 编号 | 试剂 | 前10min内产生的 氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL30% | 564.3 |
| b | 含杂质的锌 | 30mL30% | 634.7 |
| c | 纯锌 | 40mL30% | 449.3 |
| d | 纯锌 | 40mL30% | 602.8 |
②取13g含杂质的锌进行实验b,得到的氢气为2000mL,则该种锌的质量百分数___(该条件下,氢气的密度约为0.1克/升)

▼优质解答
答案和解析
(1)稀硫酸与锌反应产生硫酸锌和氢气,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑;
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,故进气管是短管e;
(3)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒)或②④(都是锌片);
(4)通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;通过①②(锌粒和锌片与质量分数相同的硫酸反应)可以看出:锌与硫酸的接触面积越大,反应速率越快;
(5)从表格可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(6)如设计温度对反应快慢的影响,具体的操作为:取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.(只要有控制变量的意识即可)
(7)①比较实验a和实验b,可以得到的结论是含杂质的锌反应速率快;
②2000mL氢气的质量=2L×0.1g/L=0.2g
设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑.
65 2
x 0.2g
=
x=6.5g
该种锌的质量百分数=
×100%=50%
故答案为:
(1)Zn+H2SO4=ZnSO4+H2↑.
(2)根据进入量筒中水的体积,判断生成氢气的体积;f.
(3)①③或②④.
(4)硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
(5)由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
(6)温度;取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.(只要有控制变量的意识即可).
(7)①含杂质的锌反应速率快;②50%.
(1)稀硫酸与锌反应产生硫酸锌和氢气,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑;
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,故进气管是短管e;
(3)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒)或②④(都是锌片);
(4)通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;通过①②(锌粒和锌片与质量分数相同的硫酸反应)可以看出:锌与硫酸的接触面积越大,反应速率越快;
(5)从表格可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢;
(6)如设计温度对反应快慢的影响,具体的操作为:取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.(只要有控制变量的意识即可)
(7)①比较实验a和实验b,可以得到的结论是含杂质的锌反应速率快;
②2000mL氢气的质量=2L×0.1g/L=0.2g
设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑.
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
x=6.5g
该种锌的质量百分数=
| 6.5g |
| 13g |
故答案为:
(1)Zn+H2SO4=ZnSO4+H2↑.
(2)根据进入量筒中水的体积,判断生成氢气的体积;f.
(3)①③或②④.
(4)硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
(5)由慢到快然后逐渐减慢;因为随着反应的进行,反应放出热量,反应速度加快,但随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
(6)温度;取质量相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间.(只要有控制变量的意识即可).
(7)①含杂质的锌反应速率快;②50%.
看了 “寒假假期”,小兵对“铁与稀...的网友还看了以下:
碳酸钡和硫酸能反应吗碳酸钙和硫酸不能反应 那碳酸钡和硫酸应该也一样啊生成硫酸钡难溶 覆盖在表面 阻 2020-05-16 …
城市冬季取暖约150天,每天消耗含硫1%的煤200t问该城市一个冬季向大气排放多少t二氧化硫?假设 2020-05-17 …
下列图象能正确反映对应变化关系的是()A.向一定量的二氧化锰中加入过氧化氢溶液B.将铁钉加入硫酸铜 2020-06-08 …
电镀厂常用10%的硫酸来去除镀锌表面的锈.如果用90%的浓硫酸和5%的稀硫酸来配制10%的硫酸溶液 2020-06-26 …
请问年假可修天数的函数怎么写?公司年假制度是每满半年6个月,就有2.5天的年假可休.例如我2011 2020-07-12 …
金矿中含有硫磺怎么去除假如金矿中含有硫磺,应该用什么化学药剂去除呢? 2020-07-13 …
能正确反映对应变化关系的图象是()A.在一定量的H2SO4和CuSO4溶液中逐滴加入NaOH溶液B. 2020-11-02 …
请问年假可修天数的函数怎么写?公司年假制度是每满半年6个月,就有2.5天的年假可休.例如我2011年 2020-12-08 …
判断下列命题的真假.并加以证明(证明一个命题是假命题,字要举出一个反例)⑴对应角相等的多边形相式2对 2021-01-01 …
现有一瓶浓硫酸标签如下:硫酸(500ml)化学式H2S04密度:1.84g/cm立方质量分数:98% 2021-02-18 …