试用杂化轨道理论说明下列分子或离子的几何构型。(1)CO2(直线形)(2)SiF4(正四面体)(3)BCl3(平面三角形)(4)NF3(三角锥形)(5)(V形)(6)N2H4(
(1)CO 2 (直线形)
(2)SiF 4 (正四面体)
(3)BCl 3 (平面三角形)
(4)NF 3 (三角锥形)
(5) 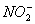 (V形)
(V形)
(6)N 2 H 4 (N—N单键,非平面形)
集线器组成的局域网在物理上形成的是______拓扑构型。A.总线型B.星形C. 树形D.环形 2020-05-23 …
采用点一点线路的通信子网的基本拓扑结构有4种,它们分别是()。A.星形、环形、树形和网状型B.总线型 2020-05-23 …
采用点-点线路的通信子网的基本拓扑结构有4种,它们分别是( )。A.星形、环形、树形和网状形B.总线 2020-05-24 …
采用点—点线路的通信子网的基本拓扑结构有4种,它们分别是()。A.星形、环形、树形和网状形B.总线型 2020-05-24 …
发电机回路的主母线采用槽形母线,型号为2*(200×90×10),请问这个母线型号每个数字代表的是 2020-07-31 …
已知,如图,一工厂车间门口由抛物线和矩形ABCO的三边组成,门的最大高度是4.9米,AB=10米,B 2020-11-04 …
已知,1图,一工厂车间门口由抛物线和矩形AuCO的三边组成,门的最我高度是4.9米,Au=12米,u 2020-11-30 …
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是()选项分子式中心原子杂 2020-12-01 …
审核员考试4管理组织的最基本结构形式是().(A)职能型(B)直线型(C)直线职能型(D)矩阵型 2020-12-05 …
管理组织的最基本结构形式,到底是哪个啊,请帮忙解答3.管理组织的最基本结构形式是().(A)职能型( 2021-01-15 …