早教吧作业答案频道 -->化学-->
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法.该法工艺原理如图.其过程是将食盐水在特定条件下电
题目详情
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法.该法工艺原理如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.
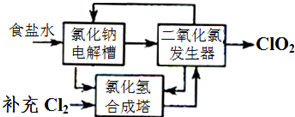
(1)工艺中可利用的单质有___(填化学式),发生器中生成ClO2的化学方程式为___.
(2)此法的缺点主要是___.
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2.
(3)配平方程式:______+___NaClO3+___H2SO4→___ClO2↑+___CO2↑+___H2O+______
(答题纸上,仅写出方程式中所有的系数以及未知物质的化学式)
若反应中产生4.48L(折算成标准状况下)气体,电子转移___个.
(4)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的___倍.
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O⇌H++OH-和___.(用离子方程式表示),常温下,0.1mol/L该溶液中离子浓度由大到小排列___(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有___.(用化学式表示)
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法.该法工艺原理如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.

(1)工艺中可利用的单质有___(填化学式),发生器中生成ClO2的化学方程式为___.
(2)此法的缺点主要是___.
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2.
(3)配平方程式:______+___NaClO3+___H2SO4→___ClO2↑+___CO2↑+___H2O+______
(答题纸上,仅写出方程式中所有的系数以及未知物质的化学式)
若反应中产生4.48L(折算成标准状况下)气体,电子转移___个.
(4)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的___倍.
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4
| △ |
| |
(5)反应中的Na2SO3溶液中存在如下平衡:H2O⇌H++OH-和___.(用离子方程式表示),常温下,0.1mol/L该溶液中离子浓度由大到小排列___(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有___.(用化学式表示)
▼优质解答
答案和解析
(1)电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl,根据流程图可知加入物质为NaClO3和HCl,生成ClO2;发生氧化还原反应,NaClO3被还原生成ClO2,HCl被氧化生成Cl2,同时生成水,反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,
故答案为:H2、Cl2;2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;
(2)生成的气体中除了有二氧化氯还有大量的氯气,产率低,难分离,而且极有可能造成大气污染;用电解的方法耗能大,
故答案为:同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;用电解的方法耗能大;
(3)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
30mol的气体~24mole-
30×22.4L 24mol
4.48L 0.16mol
所以转移电子数为0.16NA,
故答案为:1;C6H12O6;24;12;24;6;18;12;Na2SO4,0.16NA;
(4)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5;
(5)存在弱电解水的电离平衡和弱离子的水解平衡,SO32-+H2O⇌HSO3-+OH-,不水解的二元钠离子浓度最大,水解是微弱的,显性离子和第一步水解产生的阴离子,隐性离子,所以离子由大到小排列为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:SO32-+H2O⇌HSO3-+OH-,c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(6)Na2SO3溶液中滴加稀盐酸,两者反应,要使溶液呈中性,只能是部分反应,所以溶质为Na2SO3、NaHSO3、NaCl,故答案为:Na2SO3、NaHSO3、NaCl;
故答案为:H2、Cl2;2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;
(2)生成的气体中除了有二氧化氯还有大量的氯气,产率低,难分离,而且极有可能造成大气污染;用电解的方法耗能大,
故答案为:同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;用电解的方法耗能大;
(3)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
30mol的气体~24mole-
30×22.4L 24mol
4.48L 0.16mol
所以转移电子数为0.16NA,
故答案为:1;C6H12O6;24;12;24;6;18;12;Na2SO4,0.16NA;
(4)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5;
(5)存在弱电解水的电离平衡和弱离子的水解平衡,SO32-+H2O⇌HSO3-+OH-,不水解的二元钠离子浓度最大,水解是微弱的,显性离子和第一步水解产生的阴离子,隐性离子,所以离子由大到小排列为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:SO32-+H2O⇌HSO3-+OH-,c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(6)Na2SO3溶液中滴加稀盐酸,两者反应,要使溶液呈中性,只能是部分反应,所以溶质为Na2SO3、NaHSO3、NaCl,故答案为:Na2SO3、NaHSO3、NaCl;
看了二氧化氯泡腾片,有效成分(Cl...的网友还看了以下:
关于溶液剂的制法叙述错误的是( )A.制备工艺过程中先取处方中全部溶剂加药物溶解B.处方中如有附 2020-05-31 …
水质全盐量的测定重量法中:所用试剂过氧化氢溶液,1+1(V/V).用30%过氧化氢怎么配置? 2020-06-05 …
水质全盐量的测定重量法中:所用试剂过氧化氢溶液,1+1(V/V).其中1+1(V/V)是什么意思? 2020-06-05 …
检识糖时,可用的显色剂有A、茴香醛-硫酸试剂B、三苯四氮唑盐试剂C、苯胺-邻苯二甲酸试剂D、过碘酸- 2020-06-07 …
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.ClO2是一种黄绿色的气体,易 2020-07-20 …
怎样正确鉴别酸碱盐试剂下列各组溶液只用组内试剂就可以鉴别出来的是A.HCLNACLNAOHKNO3B 2020-11-03 …
(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒 2020-11-21 …
食品加工过程中常加入食品添加剂.(1)山梨酸(C6H8O2)是目前国际上公认的安全防腐剂,它属于(填 2020-12-10 …
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.实验室以NH4Cl、盐酸、NaC 2020-12-18 …
二氧化氯是一种广泛使用的安全、高效、广谱消毒剂,世界卫生组织(WHO)将其定为1A级安全消毒剂,常用 2020-12-18 …