早教吧作业答案频道 -->化学-->
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.请回答下列问题:(1)写
题目详情
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
请回答下列问题:
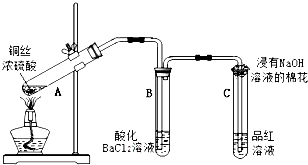
(1)写出铜与浓硫酸反应的化学方程式___;证明有SO2生成的现象是___;浸有NaOH溶液的棉花的作用是___.
(2)关于试管B中有白色沉淀生成的解释,不合理的是___.
a.硫酸分解生成了SO3b.硫酸在温度高时挥发c.SO2与氯化钡溶液反应生成BaSO3
(3)反应结束后,为检验A中有CuSO4生成,实验操作是:熄灭酒精灯并使A中溶液冷却到室温,___.
(4)若反应结束时 3.2g铜丝完全溶解,用0.1mol/L NaOH溶液滴定测定剩余硫酸的物质的量.具体操作是:首先将残余液稀释至1000mL,所需要的玻璃仪器有烧杯、玻璃棒___;接着取出残留液20mL于___(填”仪器”)中,加入酚酞指示剂,用NaOH溶液进行滴定,到达滴定终点时发现消耗NaOH溶液40mL,则剩余的硫酸有___mol.
请回答下列问题:

(1)写出铜与浓硫酸反应的化学方程式___;证明有SO2生成的现象是___;浸有NaOH溶液的棉花的作用是___.
(2)关于试管B中有白色沉淀生成的解释,不合理的是___.
a.硫酸分解生成了SO3b.硫酸在温度高时挥发c.SO2与氯化钡溶液反应生成BaSO3
(3)反应结束后,为检验A中有CuSO4生成,实验操作是:熄灭酒精灯并使A中溶液冷却到室温,___.
(4)若反应结束时 3.2g铜丝完全溶解,用0.1mol/L NaOH溶液滴定测定剩余硫酸的物质的量.具体操作是:首先将残余液稀释至1000mL,所需要的玻璃仪器有烧杯、玻璃棒___;接着取出残留液20mL于___(填”仪器”)中,加入酚酞指示剂,用NaOH溶液进行滴定,到达滴定终点时发现消耗NaOH溶液40mL,则剩余的硫酸有___mol.
▼优质解答
答案和解析
(1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水,其反应的方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,二氧化硫具有漂白性,能使品红褪色,当C中品红溶液褪色,说明反应中生成二氧化硫,二氧化硫是污染性气体属于酸性氧化物,浸有NaOH溶液的棉花可以吸收二氧化硫,防止污染环境,
故答案为:Cu+2H2SO4
CuSO4+SO2↑+2H2O;品红溶液褪色吸收SO2;防止污染环境;
(2)酸性条件下,SO2与氯化钡溶液不反应,所以B中出现变白色沉淀不可能是SO2与氯化钡溶液反应生成BaSO3,
故答案为:c;
(3)硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使A中溶液冷却到室温,取样,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色,证明铜离子的存在,取样,先加盐酸,再加BaCl2,出现白色沉淀证明含有钡离子,
故答案为:取样,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色,证明含有Cu2+;取样,先加盐酸,再加BaCl2,出现白色沉淀,证明含有SO42-;
(4)配制1000mL溶液需要烧杯、玻璃棒、1000mL容量瓶、胶头滴管,滴定实验应将待测液取放于锥形瓶中,滴入氢氧化钠溶液滴定到终点,3.2g铜丝完全溶解,溶液中铜离子的物质的量为0.05mol,Cu2++2OH-=Cu(OH)2↓,消耗氢氧根离子物质的量0.1mol,1000ml溶液反应消耗氢氧化钠总物质的量=0.1mol/L×0.040L×
=0.200mol,所以剩余氢离子物质的量=0.200mol-0.100mol=0.100mol,则剩余硫酸物质的量=0.050mol,
故答案为:1000mL容量瓶、胶头滴管;锥形瓶;0.050.
| ||
故答案为:Cu+2H2SO4
| ||
(2)酸性条件下,SO2与氯化钡溶液不反应,所以B中出现变白色沉淀不可能是SO2与氯化钡溶液反应生成BaSO3,
故答案为:c;
(3)硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使A中溶液冷却到室温,取样,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色,证明铜离子的存在,取样,先加盐酸,再加BaCl2,出现白色沉淀证明含有钡离子,
故答案为:取样,将A中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色,证明含有Cu2+;取样,先加盐酸,再加BaCl2,出现白色沉淀,证明含有SO42-;
(4)配制1000mL溶液需要烧杯、玻璃棒、1000mL容量瓶、胶头滴管,滴定实验应将待测液取放于锥形瓶中,滴入氢氧化钠溶液滴定到终点,3.2g铜丝完全溶解,溶液中铜离子的物质的量为0.05mol,Cu2++2OH-=Cu(OH)2↓,消耗氢氧根离子物质的量0.1mol,1000ml溶液反应消耗氢氧化钠总物质的量=0.1mol/L×0.040L×
| 1000 |
| 20 |
故答案为:1000mL容量瓶、胶头滴管;锥形瓶;0.050.
看了某化学兴趣小组按如图所示装置探...的网友还看了以下:
逆温是大气温度随高度增加而升高的现象,辐射逆温是由于地面强烈辐射冷却而形成的逆温。下图是某地某日( 2020-04-09 …
如图是简易散热排风示意电路,M为排风扇,R0是热敏电阻,其阻值随温度升高而减小,R是可变电阻,则( 2020-04-13 …
为什么分子间作用力随温度升高而减小?很多地方解释液体粘度随温度升高而减小的时候,都是说因为分子间作 2020-04-25 …
导体电阻一定随温度的的升高而变大吗?导体的电阻与温度的关系是?A.没有任何关系B.一定随温度的升高 2020-05-14 …
三角形三条高的大小关系有没有高分别为三分之一四分之一五分之一的三角形有是直角三角形 2020-06-05 …
一个玻璃缸长3分米,宽和高都是2分米,玻璃钢中已有15厘米高的水,小红用容积是250毫升的水杯装满 2020-06-20 …
在一个高2分米的玻璃缸中已有15厘米高的水,小明用右边的水杯装满水往玻璃缸中倒了整整11次,在一个 2020-06-20 …
要把一根长130cm的魔杖放在长为40cm,宽为30cm的长方体神龛中,长方体神龛的高的最小值是多 2020-06-21 …
一根长130CM的木根放到长40CM,宽30CM的长方体中,求高的最小值 2020-06-21 …
小而高的山用一个字表示小而高的山小而尖的山尖而高的山高而陡的山高而险的山高而大的山四周陡而顶端平的 2020-06-23 …