早教吧作业答案频道 -->化学-->
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaH
题目详情
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为___mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是___.
②上述制备碳酸氢钠的化学方程式是___.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是___(用含a、b的代数式表示).
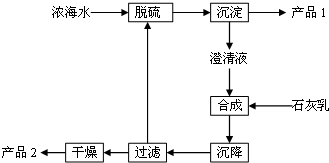
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
①脱硫阶段主要反应的离子方程式为___;
②产品2的化学式为___;1L浓海水最多可得到产品2的质量为___ g.

(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为___mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是___.
②上述制备碳酸氢钠的化学方程式是___.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是___(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品2的化学式为___;1L浓海水最多可得到产品2的质量为___ g.
▼优质解答
答案和解析
(1)一般用氯气或过氧化氢氧化Br-,反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×
×5=
mol,
故答案为:
;
(2)①氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为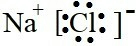 ,
,
故答案为: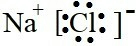 ;
;
②纯净的饱和食盐水,利用溶解度的不同,向其中加入碳酸氢铵可制备碳酸氢钠,反应的化学方程式为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl;
③量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g,设碳酸氢钠物质的量为x,含氯化钠物质的量为y,依据元素守恒列式计算,NaHCO3+HCl=NaCl+H2O+CO2↑,
84x+58.5y=a
(x+y)×58.5=b
x=
mol
样品碳酸氢钠的质量分数=
×100%=
×100%,
故答案为:
×100%,
(3)①工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,
故答案为:Ca2++SO42-═CaSO4↓:
②采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
=69.6g,
故答案为:Mg(OH)2;69.6;
| 1 |
| 1+5 |
| 5 |
| 3 |
故答案为:
| 5 |
| 3 |
(2)①氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为
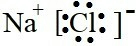 ,
,故答案为:
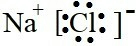 ;
;②纯净的饱和食盐水,利用溶解度的不同,向其中加入碳酸氢铵可制备碳酸氢钠,反应的化学方程式为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl;
③量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g,设碳酸氢钠物质的量为x,含氯化钠物质的量为y,依据元素守恒列式计算,NaHCO3+HCl=NaCl+H2O+CO2↑,
84x+58.5y=a
(x+y)×58.5=b
x=
| a-b |
| 25.5 |
样品碳酸氢钠的质量分数=
| ||
| ag |
| 84(a-b) |
| 25.5a |
故答案为:
| 84(a-b) |
| 25.5a |
(3)①工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,
故答案为:Ca2++SO42-═CaSO4↓:
②采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×
| 58g |
| 24g |
故答案为:Mg(OH)2;69.6;
看了将海水淡化后,从剩余的浓海水中...的网友还看了以下:
r*r-2*π*r*r/4最简是多少就是r^2-2πr^2/4化成最简 2020-04-12 …
在一个匀速圆周运动的题目中,求速度能用2πR/T吗?还是用v=根号gR,求出来两个不同的结果哦打错 2020-04-12 …
关于量子力学的用角动量量子化J=n*(hbar)推rn和En的过程中:圆轨道给出mv^2/r=e^ 2020-05-15 …
怎样使用matlab解下面的代数方程?急.syms a b c d e;2*b^2=a^2+c^2 2020-05-16 …
短周期主族元素R的族序数是其周期序数的2倍,R在其最高正价氧化物中的质量分数为40%.已知R原子核 2020-05-22 …
1+r+r^2+...+r^n=[(r^n+1)-1]/r-1如果左边取1+r+r^2,右边[(r 2020-06-02 …
圆C:(x-a)^2+(y-b)^2=r^2的切线系(x-a)cosθ+(y-b)sinθ=r是怎 2020-06-03 …
什么时候或者什么卫星是可以用mg=mV^2/r有一种情况是可以mg=mV^2/r=GMm/R^2( 2020-06-05 …
有机化合物甲、乙用于制备化妆品,二者合成路线如下(部分产物及条件略)已知:(-R、-R′代表烃基或 2020-06-14 …
如何使稀盐酸pH值升高用2种化学反应方法和1种非化学反应方法 2020-06-20 …