早教吧作业答案频道 -->化学-->
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用.(1)图1为电解精炼银的示意图,若b极有少量红棕色气体生成,则生成该气体的电极反应式为.(2)电解法处理酸性含铬
题目详情
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用.
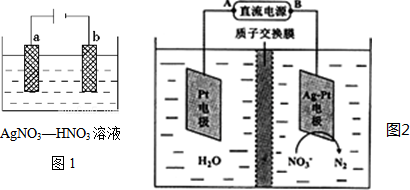
(1)图1为电解精炼银的示意图,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___.
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去.回答下列问题:
①当生成1mol Cr(OH)3时,电路中转移电子的物质的量至少为___mol.
②电解过程中有Fe(OH)3沉淀生成,原因是___.
(3)电解降解法可用于治理水中硝酸盐的污染.电解降解NO3-的原理如图2所示.
①电源正极为___(填A或B).
②若电解过程中转移了2mol电子,则质子交换膜两侧电解液的质量变化差(△m左-△m右)为___g.
(1)图1为电解精炼银的示意图,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___.

(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去.回答下列问题:
①当生成1mol Cr(OH)3时,电路中转移电子的物质的量至少为___mol.
②电解过程中有Fe(OH)3沉淀生成,原因是___.
(3)电解降解法可用于治理水中硝酸盐的污染.电解降解NO3-的原理如图2所示.
①电源正极为___(填A或B).
②若电解过程中转移了2mol电子,则质子交换膜两侧电解液的质量变化差(△m左-△m右)为___g.
▼优质解答
答案和解析
(1)b电极上生成红棕色气体,说明b电极上硝酸根离子得电子发生还原反应生成NO或NO2,生成的NO被氧气氧化生成二氧化氮,电极反应式为NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O,
故答案为:NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O;
(2)①根据Cr原子守恒知,当生成1mol Cr(OH)3时,消耗1molCr3+,生成1molCr3+,消耗3molFe2+,生成3molFe2+转移6mol电子,故答案为:6;
②阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,同时生成OH-,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀,
故答案为:阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀;
(3)①根据图知,硝酸根离子得电子发生还原反应生成氮气,为阴极,阴极连接电源负极,所以B为负极,则A为正极,故答案为:A;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g;
故答案为:14.4.
故答案为:NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O;
(2)①根据Cr原子守恒知,当生成1mol Cr(OH)3时,消耗1molCr3+,生成1molCr3+,消耗3molFe2+,生成3molFe2+转移6mol电子,故答案为:6;
②阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,同时生成OH-,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀,
故答案为:阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀;
(3)①根据图知,硝酸根离子得电子发生还原反应生成氮气,为阴极,阴极连接电源负极,所以B为负极,则A为正极,故答案为:A;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g;
故答案为:14.4.
看了电解法在金属精炼、保护环境、处...的网友还看了以下:
能正确表示下列反应的离子方程式的是()A.足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O 2020-05-14 …
1氢氧化铝与盐酸反应2氢氧化铝与硫酸反应3盐酸与硝酸银反应4硫酸与氧化钡反应5硫酸与硝酸钡反应6石 2020-06-07 …
能正确表示下列化学反应的离子方程式是A.氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2OB.澄清的 2020-07-12 …
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)= 2020-07-22 …
甲酸(HCOOH)是一种无色、有刺激性气味的液体,有较强的腐蚀性.(1)若证明甲酸具有酸性,可选用 2020-07-24 …
看下这两个氧化还原反应配平的区别反应物:高锰酸钾,硫酸亚铁,硫酸生成物:硫酸铁,硫酸2价锰,硫酸钾 2020-07-25 …
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=C 2020-11-02 …
厨房中的实验室(1)在厨房中可以自制碳酸饮料,配料表如图所示.产生的二氧化碳气体是配料表中的柠檬酸与 2020-11-24 …
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时 2020-12-09 …
能正确表示下列化学反应的离子方程式是()A.氢氧化铜溶液与硫酸的反应OH-+H+=H2OB.澄清的石 2021-02-13 …