早教吧作业答案频道 -->化学-->
甲醇又称“木精”,是非常重要的化工原料.(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学
题目详情
甲醇又称“木精”,是非常重要的化工原料.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式___.
(2)甲醇脱氢可制取甲醛CH3OH(g)
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图1所示.
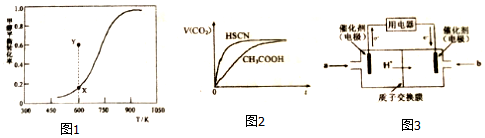
①该脱氢反应的△H___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是___
③下列叙述不能说明该脱氢反应已经达到平衡状态的是___.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___,反应结束后所得两溶液中,C(CH3COO-)___ c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为___.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式___.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |
| 脱氢 |
| |

①该脱氢反应的△H___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是___
③下列叙述不能说明该脱氢反应已经达到平衡状态的是___.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___,反应结束后所得两溶液中,C(CH3COO-)___ c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为___.
▼优质解答
答案和解析
(1)CO(g)+2H2(g)=CH3OH(g),反应热=反应物总键能-生成物总键能,故△H=1076kJ•mol-1+2×436kJ•mol-1-(3×413+351+463)kJ•mol-1=-105kJ•mol-1,故热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1;
(2)①升高温度,甲醇的平衡转化率升高,故向正反应方向进行,故正反应方向为吸热反应,△H>0,
故答案为:>;
②600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);原因是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),
故答案为:<;600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);
③A.c(CH3OH)=c(HCHO),不能说明反应达到平衡状态,故A选;
B.HCHO的体积分数保持不变,即HCHO的浓度保持不变,能说明反应达到平衡状态,故B不选;
C.V正(CH3OH)=V逆(HCHO),正逆反应速率相等,能说明反应达到平衡状态,故C不选;
D.根据质量守恒定律,及反应前后气体体积不变,故混合气体平均分子量保持不变,不能说明反应达到平衡状态,故D选,
故答案为:AD;
(3)①由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
②通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
=
=
×10-7L/mol;
故答案为:
×10-7L/mol;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+.
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1;
(2)①升高温度,甲醇的平衡转化率升高,故向正反应方向进行,故正反应方向为吸热反应,△H>0,
故答案为:>;
②600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);原因是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),
故答案为:<;600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);
③A.c(CH3OH)=c(HCHO),不能说明反应达到平衡状态,故A选;
B.HCHO的体积分数保持不变,即HCHO的浓度保持不变,能说明反应达到平衡状态,故B不选;
C.V正(CH3OH)=V逆(HCHO),正逆反应速率相等,能说明反应达到平衡状态,故C不选;
D.根据质量守恒定律,及反应前后气体体积不变,故混合气体平均分子量保持不变,不能说明反应达到平衡状态,故D选,
故答案为:AD;
(3)①由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
②通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
| c(CH3COO-)×c(H+) |
| c(CH3COOH) |
| b×10-7 | ||
|
| 2b |
| a-2b |
故答案为:
| 2b |
| a-2b |
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+.
看了甲醇又称“木精”,是非常重要的...的网友还看了以下:
碱式碳酸铜的化学式为Cu2(OH)2CO3.试计算:(1)碱式碳酸铜中的铜、氧、氢、碳四种元素的质 2020-04-11 …
证明o(x^m)+o(x^n)=o(x^m)(x→0)(n>m>0)过程请详细一些,谢谢啦请问其中 2020-06-12 …
一个n脚输入的或门是否能被n-1个二脚输入的或门替代,为什么?顺便问个布尔代数化简M.R.P+Q. 2020-06-20 …
已知圆M的方程为:x²+y²-2x-2y-6=0,以坐标原点为圆心的圆O与圆M相切已知圆M的方程为 2020-06-27 …
一个质点在平衡位置O点附近振动.如果不计阻力,可将这个振动看作周期运动.他离开O点向左运动,4S后 2020-07-20 …
一个具有O型和M型血型的个体与一个具有B型和MN型血型的个体婚配,其子女可能的血型为()A.O型和M 2020-11-01 …
请教英语中的姓名经常在英语的参考文献中看到:O.L.V.CostaandM.D.FragosoM.A 2020-11-06 …
如表为两位男性患者血常规化验报告单,请将化验结果与正常值进行对比,分析回答下列问题.姓名李伟性别男血 2020-11-20 …
酒店客房部,清扫员计件单上,有个标注,看不清是“W/O”还是“M/O”~是什么单词的拼写?酒店客房部 2020-12-10 …
三分子一氧化碳与一分子二氧化硫反应生成两分子二氧化碳和什么中考的一条推断题里有,原来是3X+C=2Y 2021-02-17 …