早教吧作业答案频道 -->化学-->
某校学生学习金属后做如下探究:①用一定量AgNO3溶液进行了如图甲实验.Ⅰ.向固体乙上滴加盐酸没有气泡产生,则固体乙的组成是.Ⅱ.溶液甲呈蓝色,溶液甲中一定含的溶质是.
题目详情
某校学生学习金属后做如下探究:
①用一定量AgNO3溶液进行了如图甲实验.
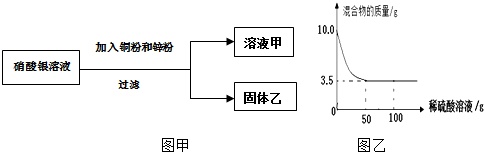
Ⅰ.向固体乙上滴加盐酸没有气泡产生,则固体乙的组成是___.
Ⅱ.溶液甲呈蓝色,溶液甲中一定含的溶质是___.
使溶液呈蓝色的化学反应是___ (写化学方程式),该反应的基本类型是___.
②称取铜粉和锌粉混合物10.0克,逐滴滴入100克稀硫酸溶液,实验情况如图乙所示.
Ⅰ.混合物中Zn的物质的量是___mol.
Ⅱ.稀硫酸溶液中溶质的质量分数.
①用一定量AgNO3溶液进行了如图甲实验.

Ⅰ.向固体乙上滴加盐酸没有气泡产生,则固体乙的组成是___.
Ⅱ.溶液甲呈蓝色,溶液甲中一定含的溶质是___.
使溶液呈蓝色的化学反应是___ (写化学方程式),该反应的基本类型是___.
②称取铜粉和锌粉混合物10.0克,逐滴滴入100克稀硫酸溶液,实验情况如图乙所示.
Ⅰ.混合物中Zn的物质的量是___mol.
Ⅱ.稀硫酸溶液中溶质的质量分数.
▼优质解答
答案和解析
①实验后,溶液甲呈蓝色,说明含有铜盐,则锌粉不足,因此向固体乙上滴加盐酸时没有气泡产生;由金属活动性顺序及其运用可知,金属活动性Al>Zn>Cu>Ag,所以锌粉优先与AgNO3发生反应,铜粉后与AgNO3发生反应,由于锌粉量的不足,没有把硝酸铜溶液中的铜置换出来,因此溶液甲一定含有反应生成的Zn (NO3)2和剩余的Cu(NO3)2,可能含有AgNO3,滤渣中一定含有被置换出的银,可能含有铜,由以上分析可知,
Ⅰ.由于锌不足,因此向固体乙上滴加盐酸时没有气泡产生;固体乙中金属的成分是银或银和铜;
Ⅱ.溶液甲中一定含有的溶质是Cu(NO3)2、Zn(NO3)2;使溶液呈蓝色的化学反应是Cu+2AgNO3=Cu(NO3)2+2Ag (写化学方程式),该反应的基本类型是置换反应;
②Ⅰ.由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为3.5g,则锌的质量为10g-3.5g=6.5g,故混合物中Zn的物质的量是
=0.1mol.
Ⅱ.设反应中消耗稀硫酸溶液中溶质的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
6.5g x
则
=
,解得x=9.8g.
所用稀硫酸溶液中溶质的质量分数为:
×100%=19.6%.
答:所用稀硫酸溶液中溶质的质量分数是19.6%.
故答案为:
①Ⅰ. 银或银和铜.
Ⅱ. Cu(NO3)2、Zn(NO3)2. Cu+2AgNO3=Cu(NO3)2+2Ag,置换反应.
②Ⅰ. 0.1.Ⅱ.19.6%
Ⅰ.由于锌不足,因此向固体乙上滴加盐酸时没有气泡产生;固体乙中金属的成分是银或银和铜;
Ⅱ.溶液甲中一定含有的溶质是Cu(NO3)2、Zn(NO3)2;使溶液呈蓝色的化学反应是Cu+2AgNO3=Cu(NO3)2+2Ag (写化学方程式),该反应的基本类型是置换反应;
②Ⅰ.由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为3.5g,则锌的质量为10g-3.5g=6.5g,故混合物中Zn的物质的量是
| 6.5g |
| 65g/mol |
Ⅱ.设反应中消耗稀硫酸溶液中溶质的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
6.5g x
则
| 65 |
| 98 |
| 6.5g |
| x |
所用稀硫酸溶液中溶质的质量分数为:
| 9.8g |
| 50g |
答:所用稀硫酸溶液中溶质的质量分数是19.6%.
故答案为:
①Ⅰ. 银或银和铜.
Ⅱ. Cu(NO3)2、Zn(NO3)2. Cu+2AgNO3=Cu(NO3)2+2Ag,置换反应.
②Ⅰ. 0.1.Ⅱ.19.6%
看了 某校学生学习金属后做如下探究...的网友还看了以下:
在闻一多先生说和做中饭,几乎忘记了吃,他贪得是精神食粮.(贪好在哪里?根据下面的句子仿写一个比喻句 2020-04-07 …
他正向古代典籍钻探,有如向地壳寻求宝藏一句使用了什么修辞手法? 2020-04-26 …
他正向古代典籍钻探,有如向地壳寻求宝藏问有何作用? 2020-04-26 …
“他正向古代典籍钻探,有如向地壳寻求宝藏”一句,用比喻的手法,形象地说明了闻一多先生钻研学问的艰难 2020-04-26 …
闻一多的说和做阅读作为学者和诗人的闻一多先生,在30年代国立青岛大学的两年时间,我对他是有着深刻印 2020-05-02 …
他正向古代典籍钻探,有如向地壳寻求宝藏.仰之弥高,越高,攀得越起劲,钻得越锲而不舍这句话节选自《闻 2020-05-16 …
作为学者和诗人的闻一多先生,在30年代国立青岛大学的两年时间,我对他是有着深刻印象的.那时候,他已 2020-05-16 …
指出句子所运用的修辞手法:1.他正向古代典籍钻探,有如向地壳寻求宝藏2.闻先生大无畏地在群众大会上 2020-05-21 …
他正向古代典籍钻探,有如向地壳寻求宝藏一句使用了什么修辞手法? 2020-05-21 …
初中语文的同义词题目(要求指出出自哪篇文章,并且选项是意思相近的动词或形容词)给个示例如:1,那时候 2021-01-12 …