早教吧作业答案频道 -->化学-->
氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:MgH2(s)⇌Mg(s)+H2(g)△H12Mg(s)+O2(g)⇌2MgO(s)△H22MgO(s)+2SO2(g)⇌2MgSO4(s)△H3(1)①MgH2的电子式为
题目详情
氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:
MgH2(s)⇌Mg(s)+H2(g)△H1
2Mg(s)+O2(g)⇌2MgO(s)△H2
2MgO(s)+2SO2(g)⇌2MgSO4(s)△H3
(1)①MgH2的电子式为___.
②反应:SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=___(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示.
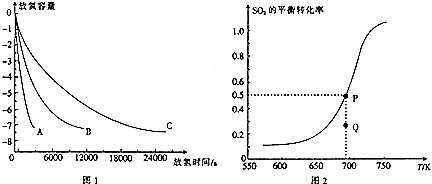
则粒径A、B、C从小到大的顺序是___.
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2,发生反应:2MgO(s)+2SO2(g)+O2(g)⇌2MgSO4(s)△H3,测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3___(填“>”或“<“,下同)0;Q点的反应速率:v(正)___v(逆).
②P点对应温度下该反应的平衡常数为___.
③为提高SO2的转化率,除改变温度外,还可采取的措施有___(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为___.7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为___.
MgH2(s)⇌Mg(s)+H2(g)△H1
2Mg(s)+O2(g)⇌2MgO(s)△H2
2MgO(s)+2SO2(g)⇌2MgSO4(s)△H3
(1)①MgH2的电子式为___.
②反应:SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=___(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示.

则粒径A、B、C从小到大的顺序是___.
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2,发生反应:2MgO(s)+2SO2(g)+O2(g)⇌2MgSO4(s)△H3,测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3___(填“>”或“<“,下同)0;Q点的反应速率:v(正)___v(逆).
②P点对应温度下该反应的平衡常数为___.
③为提高SO2的转化率,除改变温度外,还可采取的措施有___(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为___.7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为___.
▼优质解答
答案和解析
(1)①MgH2为离子化合物,电子式为[H:]-Mg2+[H:]-,故答案为:[H:]-Mg2+[H:]-;
②ⅠMgH2(s)⇌Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)⇌2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)⇌2MgSO4(s)△H3
根据盖斯定律,Ⅰ+
(Ⅱ+Ⅲ)得SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=△H1+
(△H2+△H3),故答案为:△H1+
(△H2+△H3);
(2)因为粒径越小,接触面积越大,反应速率越快,由图象可知,反应速率A>B>C,所以粒径A、B、C从小到大的顺序是A<B<C,故答案为:A<B<C;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动,则△H3<0;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,则v(正)>v(逆),故答案为:<;>;
②由图可知P点SO2的转化率为0.5,所以平衡时剩余0.5molSO2和0.25molO2,又K=
=
=128,故答案为:128;
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行,所以除改变温度外,还可采取的措施有增大压强或者增大氧气的量,故答案为:增大压强或者增大氧气的量;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,化学方程式为:Mg17Al12+17H2=17MgH2+12Al,所以7.32g即
=0.01molMg17Al12生成0.17molMgH2和0.12mol金属铝,又氢化镁和金属铝与足量稀H2SO4反应方程式分别为:MgH2+H2SO4=MgSO4+2H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,所以生成氢气在标准状况下的体积为(0.17mol×2+0.12mol×
)×22.4L/mol=11.648L,故答案为:Mg17Al12+17H2=17MgH2+12Al;11.648L.
②ⅠMgH2(s)⇌Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)⇌2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)⇌2MgSO4(s)△H3
根据盖斯定律,Ⅰ+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)因为粒径越小,接触面积越大,反应速率越快,由图象可知,反应速率A>B>C,所以粒径A、B、C从小到大的顺序是A<B<C,故答案为:A<B<C;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动,则△H3<0;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,则v(正)>v(逆),故答案为:<;>;
②由图可知P点SO2的转化率为0.5,所以平衡时剩余0.5molSO2和0.25molO2,又K=
| 1 |
| c(SO 2) 2c(O 2) |
| 1 | ||||
(
|
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行,所以除改变温度外,还可采取的措施有增大压强或者增大氧气的量,故答案为:增大压强或者增大氧气的量;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,化学方程式为:Mg17Al12+17H2=17MgH2+12Al,所以7.32g即
| 7.32g |
| 732g/mol |
| 3 |
| 2 |
看了 氢化镁(MgH2)既可用于劣...的网友还看了以下:
CO是常见的化学物质,在工业生产中用途很广泛.(1)已知:某些反应的热化学方程式如下:2H2(g) 2020-04-07 …
研究发现,NOx和SO2是雾霾的主要成分,已知:2CO(g)+O2(g)⇌CO2(g)△H1=-5 2020-04-07 …
现已知:2H2(g)+O2(g)=2H2O(l),△H=-572kJ/mol;H-H键的键能为43 2020-04-07 …
(2014•重庆)已知C(s)+H2O(g)═CO(g)+H2(g)△H=akJ•mol-12C( 2020-07-09 …
已知2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol.且氧气中1molO=O键完 2020-07-09 …
乙醛酸(OHC-COOH)是合成名贵香料的原料之一.I.由乙二醛催化氧化制乙醛酸的反应如下:2OH 2020-07-12 …
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-12C(s)+O2 2020-07-13 …
I.已知:反应4HCl(g)+O2(g)CuO/CuCI400℃2Cl2(g)+2H2O(g)△H 2020-07-17 …
已知:反应4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)△H=-115.6kJ/mol 2020-07-18 …
已知在25℃时:2C(s)+O2(g)=2CO(g)△H1=-222kJ/mol2H2(g)+O2 2020-07-19 …