早教吧作业答案频道 -->化学-->
镁、铁、钨、钒的化合物在科学研究和工业生产中用途非常广泛.Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1(1)写出M
题目详情
镁、铁、钨、钒的化合物在科学研究和工业生产中用途非常广泛.
Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
(1)写出Mg2Ni和MgH2 反应生成Mg和Mg2NiH4的热化学方程式:___
(2)一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)⇌WI2(g),为模拟上述反应,在实验室中准确称取4.5×10-3mol碘、6.0×10-3mol金属钨放置于50.0mL密闭容器中,并加热使其反应.如图1是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.请回答下列问题:
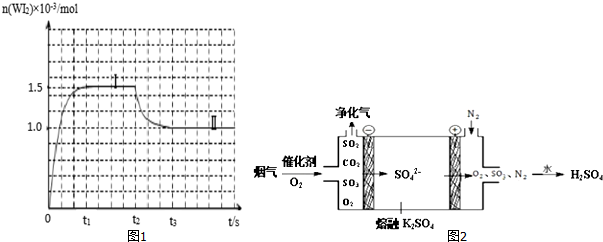
①该反应是___(填“放热”或“吸热”)反应.450℃该反应的化学平衡常数K=___;
②反应从开始到t1(t1=3min)时间内的平均速率:v(I2)=___
③能够说明上述反应已经达到平衡状态的有___
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物
质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)烟气(主要含SO2、CO2)在较高温度经如图2所示方法脱除SO2,并制得H2SO4.
①在阴极放电的物质是___.
②在阳极生成SO3的电极反应式是___.
Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
(1)写出Mg2Ni和MgH2 反应生成Mg和Mg2NiH4的热化学方程式:___
(2)一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)⇌WI2(g),为模拟上述反应,在实验室中准确称取4.5×10-3mol碘、6.0×10-3mol金属钨放置于50.0mL密闭容器中,并加热使其反应.如图1是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.请回答下列问题:

①该反应是___(填“放热”或“吸热”)反应.450℃该反应的化学平衡常数K=___;
②反应从开始到t1(t1=3min)时间内的平均速率:v(I2)=___
③能够说明上述反应已经达到平衡状态的有___
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物
质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)烟气(主要含SO2、CO2)在较高温度经如图2所示方法脱除SO2,并制得H2SO4.
①在阴极放电的物质是___.
②在阳极生成SO3的电极反应式是___.
▼优质解答
答案和解析
(1)已知:①Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
根据盖斯定律,②-①×2可得:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol,
故答案为:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol;
(2)①由图可知,升高温度,WI2的物质的量减少,说明化学平衡逆向移动,正反应为放热反应;
450℃平衡时,n(WI2)=1.5×10-3mol,则n(I2)=4.5×10-3mol-1.5×10-3mol=3×10-3mol,反应前后气体体积不变,用物质的量代替浓度计算平衡常数,则K=
=
=0.5,
故答案为:放热;0.5;
②△n(I2)=n(WI2)=1.5×10-3mol,则v(I2)=
=1.0×10-2mol•L-1•min-1,
故答案为:1.0×10-2mol•L-1•min-1;
③a.平衡时I2与WI2的浓度与碘的转化率有关,平衡时不一定相等,故a错误;
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明单质碘的生成速率与消耗速率相等,反应到达平衡,故b正确;
c.容器容积不变,随反应进行容器内混合气体总质量增大,容器内混合气体的密度增大,当混合气体密度不再改变时,反应到达平衡,故c正确;
d.反应前后气体物质的量不变,恒温恒容下容器内气体压强始终不变,故d错误,
故选:bc;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑.
②Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
根据盖斯定律,②-①×2可得:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol,
故答案为:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol;
(2)①由图可知,升高温度,WI2的物质的量减少,说明化学平衡逆向移动,正反应为放热反应;
450℃平衡时,n(WI2)=1.5×10-3mol,则n(I2)=4.5×10-3mol-1.5×10-3mol=3×10-3mol,反应前后气体体积不变,用物质的量代替浓度计算平衡常数,则K=
| c(WI2) |
| c(I2) |
| 1.5×10-3 |
| 3×10-3 |
故答案为:放热;0.5;
②△n(I2)=n(WI2)=1.5×10-3mol,则v(I2)=
| ||
| 3min |
故答案为:1.0×10-2mol•L-1•min-1;
③a.平衡时I2与WI2的浓度与碘的转化率有关,平衡时不一定相等,故a错误;
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明单质碘的生成速率与消耗速率相等,反应到达平衡,故b正确;
c.容器容积不变,随反应进行容器内混合气体总质量增大,容器内混合气体的密度增大,当混合气体密度不再改变时,反应到达平衡,故c正确;
d.反应前后气体物质的量不变,恒温恒容下容器内气体压强始终不变,故d错误,
故选:bc;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑.
看了 镁、铁、钨、钒的化合物在科学...的网友还看了以下:
一道java编程题:有一矩阵:a b c d e f g h i j k l m n o p q 2020-04-06 …
求破解下面拼音组成的句子Y-Q,R-M-D-R-Z-S-N-M-D-X-K,G-L-W-M-90- 2020-05-17 …
下列哪一个关键码序列不符合堆的定义?下列哪一个关键码序列不符合堆的定义?(C)A.a、c、d、g、 2020-05-22 …
在平面直角坐标系xOy中,椭圆C的中心为原点,焦点F1,F2在x轴上,离心率为12.过F1的直线交 2020-06-21 …
求证E,F,G,M,N,H六点共面已知正方体ABCD-A1B1C1D1中,点E,F,G,H,M,N 2020-07-09 …
已知函数f(x)=+xlnx(m>0),g(x)=lnx-2.(1)当m=1时,求函数f(x)的单 2020-07-17 …
导数乘法证明中h是什么意思?(f(x)g(x))'=lim(h→0)[f(x+h)g(x+h)-f 2020-07-22 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
木工要用一个正方形木板制成一个正八边形,采取了如下作图:先确定正方形ABCD的中心O,再分别以A,B 2020-12-01 …
已知函数f(x)=ax3+x2+bx(a,b∈R,且F(x)=f(x)+3ax2+2x+b为奇函数. 2020-12-08 …