酸和碱是初中化学里的两种重要物质.(1)打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口出现白雾的是,过一段时间后该溶液的pH(变大、变小、不变).(2)浓硫酸具
酸和碱是初中化学里的两种重要物质.
(1)打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口出现白雾的是 ,过一段时间后该溶液的pH
(变大、变小、不变).
(2)浓硫酸具有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它.其原因是 (写出一条即可).
(3)氢氧化钠是一种重要的碱,固体氢氧化钠在实验室中必须密封保存原因 .
(4)酸和碱的中和反应在工农业生产中有着广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为: .
(5)钙片(主要成分为碳酸钙)可用于预防和治疗钙缺乏症,其中碳酸钙含量的测定方法是将样品粉碎,加入足量的稀盐酸,根据产生气体的体积计算样品中碳酸钙的含量.
根据所示实验装置图,回答问题:
①装置B中放置植物油的目的是 .
②如何测出产生气体的体积? .
③取l0g钙片样品放在烧杯中,向其中注入一定量的稀盐酸,使之与样品充分反应(杂质不参与反应).产生气体的质量与所加入稀盐酸的质量的关系如图C所示.试计算样品中CaCO3的质量分数是多少?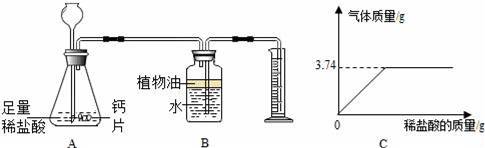

【考点】碱的化学性质;酸的物理性质及用途;常见碱的特性和用途;中和反应及其应用;根据化学反应方程式的计算.
【分析】(1)浓盐酸易挥发;
(2)浓硫酸具有吸水性,腐蚀性和强氧化性;
(3)氢氧化钠能够吸收水蒸气和二氧化碳;
(4)稀硫酸和氢氧化钙反应生成硫酸钙和水;
(5)二氧化碳能够溶于水,不溶于植物油;
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳质量可以计算碳酸钙质量,进一步可以计算样品中碳酸钙质量分数.
【解答】(1)打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口出现白雾的是浓盐酸,过一段时间后该溶液酸性减弱,溶液的pH变大.
故填:浓盐酸;变大.
(2)浓硫酸具有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它.其原因是具有腐蚀性.
故填:具有腐蚀性.
(3)氢氧化钠是一种重要的碱,固体氢氧化钠在实验室中必须密封保存原因是氢氧化钠能够吸收水和二氧化碳.
故填:氢氧化钠能够吸收水和二氧化碳.
(4)硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为:Ca(OH)2+H2SO4═CaSO4+2H2O.
故填:Ca(OH)2+H2SO4═CaSO4+2H2O.
(5)①装置B中放置植物油的目的是防止二氧化碳溶于水.
故填:防止二氧化碳溶于水.
②排入量筒中的水的体积即为反应生成二氧化碳的体积.
故填:排入量筒中的水的体积即为反应生成二氧化碳的体积.
③设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.74g
![]()
![]() =
=![]()
![]() ,
,
x=8.5g,
样品中CaCO3的质量分数是:![]()
![]() ×100%=85%,
×100%=85%,
答:样品中CaCO3的质量分数是85%.
(2013•天河区一模)玻璃瓶内有一些水,给瓶内打气一段时间,瓶塞跳出,在瓶塞跳出的过程中()A. 2020-05-17 …
如果热水瓶中的热水末灌满而盖紧瓶塞(瓶塞的密封程度很好),那么经过一段时间,想把瓶塞拔出来却很费力 2020-07-04 …
开启热水瓶塞如果热水瓶中的热水未灌满而盖紧瓶塞,瓶的密闭程度又很好的话,那么经过一段时间,你会感到 2020-07-12 …
玻璃瓶内有一些水,给瓶内打气一段时间,瓶塞跳出(如图),在瓶塞跳出的过程中()A.瓶口出现白雾,白雾 2020-11-05 …
在冬天,装有一定量水的热水瓶过了一段时间后,软木塞不易拨出,这主要是由于()A.瓶内气压大于大气压B 2020-11-08 …
问两个生活常识(也可以算是物理常识)1.为什么往保温瓶内灌入大半瓶开水后,塞上木塞,木赛会跳出来?2 2020-11-21 …
玻璃瓶内有一些水,给瓶内打气一段时间,瓶塞跳出,在瓶塞跳出的过程中()A.瓶口出现白雾,白雾是水蒸气 2020-11-22 …
如图大口玻璃瓶内有一些水,水上方有水蒸气,塞紧瓶塞用打气筒向瓶内打气.(1)可观察到在瓶塞跳出来的同 2020-11-22 …
如图所示,瓶内装有少量的水,水上方有水蒸气,塞紧瓶塞,用打气筒向瓶内打气,当塞子从瓶口跳起时.(1) 2020-11-22 …
往保温瓶中灌入大半瓶开水,赛上木塞,忽然听到‘噗’的一声木塞蹦出来了同时看到一股白气从瓶中冒出.而保 2020-12-14 …