常温下,用0.1mol•L-1NaOH溶液滴定0.1mol•L-1HA溶液,滴定曲线如下,下列分析错误的是()A.由a点推知HA是弱酸B.a、b点的溶液中,水的电离程度:a<bC.c点的溶液中:c(Na+)=c(A-)+c
常温下,用0.1mol•L-1NaOH溶液滴定0.1mol•L-1HA溶液,滴定曲线如下,下列分析错误的是( )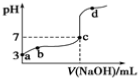
A. 由a点推知HA是弱酸
B. a、b点的溶液中,水的电离程度:a<b
C. c点的溶液中:c(Na+)=c(A-)+c(HA)
D. d点的溶液中:c(Na+)>c(A-)
B.a、b点的溶液都呈酸性,氢离子抑制了水的电离,由于a点氢离子浓度大于b,则水的电离程度:a
D.根据图示可知,d点显示碱性:c(H+)
故选C.
一道三角形的最值问题!在等边三角形ABC中,AB=a,O为三角形的中心,过O点的直线交AB于M,交 2020-04-10 …
设NA为阿佛加德罗常数(1)4.9g硫酸中含有molH原子,个O原子和个S原子,与克H2O中所含O 2020-04-13 …
5.将2.4克镁和铝的混合物投入50克稀盐酸中,恰好安全反应,则盐酸溶液中溶 A.7 2020-05-20 …
在等边三角形ABC中,AB=a,O为三角形的中心,过O点的直线叫AB于M,交AC于N,求1/(OM 2020-06-21 …
在平面直角坐标系中,过A,O,C做圆O1,点E是劣弧AO上一点,连EC,EA,EO,当点E在劣弧A 2020-06-23 …
向一定量的氯化镁溶液中,加入硝酸银溶液至恰好完全反应,过滤,所得滤液的质量刚好等于所加硝酸银溶液的 2020-07-07 …
下列文字表述与反应方程式对应且正确的是()A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+ 2020-07-29 …
已知关于x的不等式组5-2x≥-1x-a大于0无解,a的取值范围是≥3若只将不等式组中X-a>o改 2020-07-31 …
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m与加入Ba( 2020-11-02 …
设NA为阿伏加德罗常数的值,下列有关叙述正确的是A.0.1molNH3溶于足量水中(不考虑氨气挥发) 2021-01-10 …