早教吧作业答案频道 -->化学-->
氨气在工业上有广泛用途.请回答以下问题:(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/LH2参加合成氨反应,在a、b两种条
题目详情
氨气在工业上有广泛用途.请回答以下问题:
(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A.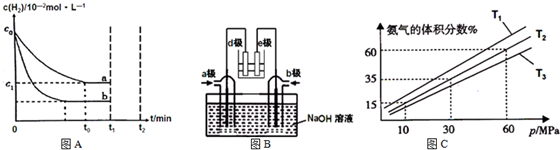
①相对a而言,b可能改变的条件是___,判断的理由是___.
②a条件下,0~t0的平均反应速率v(N2)=___mol•L-1•min-1.
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝.
a极通入___气体(填化学式),判断的理由是___
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为___.
③此时N2的平衡分压为___MPa.(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=___.(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A.

①相对a而言,b可能改变的条件是___,判断的理由是___.
②a条件下,0~t0的平均反应速率v(N2)=___mol•L-1•min-1.
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝.
a极通入___气体(填化学式),判断的理由是___
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为___.
③此时N2的平衡分压为___MPa.(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=___.(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
▼优质解答
答案和解析
(1)①a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),
故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=
v(H2)=
×
=
×
=
mol/(L.min),
故答案为:
;
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,
故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;
b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;
c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;
d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;
故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,
故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)⇌2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=
×100%=60%,
x=12,
氮气分压=
×60MPa=9MPa;
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=
=0.043(MPa)-2,
故答案为:9;0.043(MPa)-2.
故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=
| 1 |
| 3 |
| 1 |
| 3 |
| △c |
| △t |
| 1 |
| 3 |
| (c0-c1)mol/L |
| 100t0min |
| c0-c1 |
| 300t0 |
故答案为:
| c0-c1 |
| 300t0 |
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,
故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;
b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;
c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;
d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;
故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,
故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)⇌2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=
| x |
| 9-0.5x+23-1.5x+x |
x=12,
氮气分压=
| 9-0.5×12 |
| 9+23-12 |
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=
| (36MPa)2 |
| (9MPa).(15MPa)3 |
故答案为:9;0.043(MPa)-2.
看了 氨气在工业上有广泛用途.请回...的网友还看了以下:
氨气的燃烧热的热化学方程式NH3(g)燃烧生成NO2和H2O,已知(1)H2(g)+1/2O2(g 2020-05-14 …
用符号f和g分别表示一种运算,他们对一些数的运算结果如下(1) f(1)=2 f(2)=-3 f( 2020-05-16 …
用符号"f"和"g"分别表示一种运算,它们对一些数的运算结果如下:(1)f(1)=2,f(2)=3 2020-05-16 …
设f(x)=x+3,x∈[-3,3],g(x)=x^2-5x,(0≤x≤3)且g(x)=0,(x> 2020-06-18 …
f(3)=4,g(3)=2,f`(3)=-5,g`(3)=6那么(f+g)`(3)=?(fg)`( 2020-07-09 …
如何用matlab解方程组?这个八个未知数的方程组是不是用matlab解不出来?[a,b,c,d, 2020-07-09 …
正整数可以分为两个互不相交的正整数子集:{f(1),f(2),f(3)...f(n)...};{g 2020-07-20 …
对一般的二维数组G而言,当()时,其按行存储的G[I,J]的地址与按列存储的G[J,I]的地址相同 2020-07-31 …
求证一道求逆函数的题原题是这样的函数f(x)=3x^2-4(x>=0),回答以下问题1.求f(x)的 2020-11-20 …
若逻辑函数F=∑m(1,2,3,6)G=∑m(0,2,3,4,5,7),则F和G相与的结果为多少?首 2020-11-27 …