早教吧作业答案频道 -->化学-->
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳一化学”途径制取
题目详情
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
焦炭
CO
草酸二甲酯
乙二醇
(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH).你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)___;
(2)如图1表示在恒温恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图.
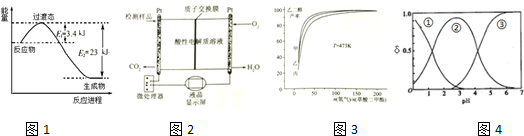
①写出该反应的热化学方程式:___.
②能判断该反应达到化学平衡状态的依据是___.
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中气体密度不变
(3)如图2所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:负极___.
(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图3表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2,.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___.
(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸.H2C2O4水溶液中H2C2O4、HC2O
和C2O
三种形态的粒子的分布分数δ随溶液pH变化的关系如图4所示曲线①代表的粒子是___;草酸氢钾溶液中存在如下平衡:H2O⇌H++OH-,HC2O
⇌H++C2O
和___;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将___,CaC2O4的溶解度将___.(填“增大”“减小”或“不变”)
焦炭
| 水蒸气 |
| |
| 高温 |
| 氧化偶联 |
| |
| 催化还原 |
| |
(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH).你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)___;
(2)如图1表示在恒温恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图.

①写出该反应的热化学方程式:___.
②能判断该反应达到化学平衡状态的依据是___.
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中气体密度不变
(3)如图2所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:负极___.
(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图3表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2,.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___.
(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸.H2C2O4水溶液中H2C2O4、HC2O
| - 4 |
| 2- 4 |
| - 4 |
| 2- 4 |
▼优质解答
答案和解析
(1)以CO与H2为原料,在一定条件下均可合成甲醇:CO(g)+2H2(g)
CH3OH(g);以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g)
CH3OH(g))+H2O,以CO与H2为原料,产物只有一种,符合符合“绿色化学”的思想;
故答案为:CO(g)+2H2(g)
CH3OH(g);
(2)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-
×2=-49kJ•mol-1;
故答案为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49 kJ•mol-1;
②a.该反应气体体积减小,在恒容容器中压强减小,不再改变说明达到了平衡状态,故a正确;
b.混合气体中 H2的体积分数不变,说明各组分的体积分数都不变,正逆反应速率,达到了平衡状态,故b正确;
c.c(H2)=3c(CH3OH)不能说明达到平衡状态,故c错误;
d.反应两边都是气体,气体总质量不变,恒压条件该容器的容积不变,故气体的密度不变,不能说明达到了平衡状态,故d错误;
(3)负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:负极:CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2;
(4)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(丙)=1.5MPa,
故答案为:1.5MPa;
(5)根据图片知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;
草酸氢钾溶液中有水的电离平衡、草酸氢根离子的水解及电离,故有:H2O⇌H++OH-,HC2O4-⇌H++C2O42-和H2O+HC2O4-⇌H2C2O4+OH-;
一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)⇌C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,CaC2O4的溶解度将减小;
故答案为:H2C2O4;H2O+HC2O4-⇌H2C2O4+OH-;增大;减小.
| 一定条件 |
| 一定条件 |
故答案为:CO(g)+2H2(g)
| 一定条件 |
(2)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-
| 19.6 |
| 80% |
故答案为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49 kJ•mol-1;
②a.该反应气体体积减小,在恒容容器中压强减小,不再改变说明达到了平衡状态,故a正确;
b.混合气体中 H2的体积分数不变,说明各组分的体积分数都不变,正逆反应速率,达到了平衡状态,故b正确;
c.c(H2)=3c(CH3OH)不能说明达到平衡状态,故c错误;
d.反应两边都是气体,气体总质量不变,恒压条件该容器的容积不变,故气体的密度不变,不能说明达到了平衡状态,故d错误;
(3)负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:负极:CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2;
(4)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(丙)=1.5MPa,
故答案为:1.5MPa;
(5)根据图片知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;
草酸氢钾溶液中有水的电离平衡、草酸氢根离子的水解及电离,故有:H2O⇌H++OH-,HC2O4-⇌H++C2O42-和H2O+HC2O4-⇌H2C2O4+OH-;
一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)⇌C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,CaC2O4的溶解度将减小;
故答案为:H2C2O4;H2O+HC2O4-⇌H2C2O4+OH-;增大;减小.
看了 有效利用现有资源是解决能源问...的网友还看了以下:
19.在下面一段文字横线处补写恰当的词语或句子,使整段文字语意完整连贯,内容贴切,逻辑严密。。从神 2020-05-14 …
诺贝尔的6个奖项用英文分别怎么写?物理化学生理学或医学文学和平经济学加上“诺贝尔”这3个字.. 2020-05-14 …
为什么上来初中后,我发现我的写作水平不如以前了?前几天我写了一篇作文,但和小学的一经对比,发现我写 2020-05-14 …
零级动力学和一级动力学的区别~简答题来着,是药物零级动力学消除和一级动力学消除的不同点~ 2020-06-05 …
本人今年读大一下,上学期刚学完高数上,这学期刚学大学物理,里面有个对dv=adt和dr=vdt两边 2020-06-11 …
关于“211工程”的说法正确的是()A、为推动各级教育而提出B、在全国建立100所大学和一批重点学 2020-06-11 …
华裔美国科学家钱永健夺得2008年度诺贝尔化学奖,他发明多色莹光蛋白标记技术,为细胞生物学和神经生 2020-06-29 …
大脑对事物的喜好的客观本质(物理学和神经学)本质是什么,怎么产生的? 2020-11-05 …
(2005•赤峰)如图所示,一名男同学和一名女同学用一根轻木棒抬重物.男同学为了减轻女同学的负担,他 2020-12-06 …
2008年诺贝尔奖化学奖获得者之一是中国导弹之父钱学森的堂侄钱永健,他发明多色莹光蛋白标记技术,为细 2021-01-12 …