早教吧作业答案频道 -->化学-->
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.实验步骤:将一定量FeSO4固体置于硬质玻璃管中,打开
题目详情
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.
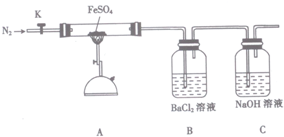
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.
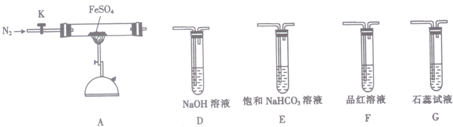
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.44

42
操作步骤 实验现象 用化学方程式解释原因 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 洗气瓶B中① ___ ② ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___ 操作步骤 实验现象 用化学方程式解释原因 操作步骤 实验现象 用化学方程式解释原因 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 洗气瓶B中① ___ ② ___ 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 2洗气瓶B中① ___ ② ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___


实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.44

42
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

▼优质解答
答案和解析
(1)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物,金属氧化物为铁的氧化物,铁元素70%,氧元素占30%,铁元素和氧元素物质的量之比=
:
=2:3,化学式为Fe2O3,
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
70% 56 70% 70% 70%56 56 56:
=2:3,化学式为Fe2O3,
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
30% 16 30% 30% 30%16 16 16=2:3,化学式为Fe22O33,
故答案为:Fe22O33;
(2)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M为Fe22O33和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO22、SO33生成,打开K,通入一段时间的N22,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO33+H22O+BaCl22=BaSO44↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO44
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
高温 高温 高温 高温 Fe22O33+SO22↑+SO33↑,
故答案为:①有白色沉淀生成;②SO33+H22O+BaCl22=BaSO44↓+2HCl;③有红棕色固体物质生成;④2FeSO44
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
高温 高温 高温 高温 Fe22O33+SO22↑+SO33↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO22,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 70% |
| 56 |
| 30% |
| 16 |
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 70% |
| 56 |
| 30% |
| 16 |
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 30% |
| 16 |
故答案为:Fe22O33;
(2)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M为Fe22O33和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO22、SO33生成,打开K,通入一段时间的N22,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO33+H22O+BaCl22=BaSO44↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO44
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| ||
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
.
.
.
.
.故答案为:①有白色沉淀生成;②SO33+H22O+BaCl22=BaSO44↓+2HCl;③有红棕色固体物质生成;④2FeSO44
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| ||
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
.
.
.
.
.(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO22,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
看了 硫酸亚铁(FeSO4)加热至...的网友还看了以下:
(12分)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式 2020-05-16 …
烟气脱硫能有效减少二氧化硫的排放.实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[A 2020-05-16 …
等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2, 2020-06-04 …
碳、硫的含量影响钢铁性能.某兴趣小组用如下流程如图1对钢样进行探究.(1)钢样中硫元素以FeS形式 2020-06-28 …
由C、H、O三种元素组成的有机物A,相对分子质量为104.0.1molA充分燃烧后,将所得产物依次 2020-07-18 …
小敏发现长期露置在空气中的铜表面会被锈蚀,于是她想探究铜锈蚀的原因.经检测,锈蚀物中除含有铜元素外, 2020-10-30 …
Na2S2O3(硫代硫酸钠)是常用的化工原料,下列说法正确的是(1)硫代硫酸钠的相对分子质量为;(2 2020-11-04 …
某研究小组为了探究一种无机矿物盐X(仅含Ca、Fe、C、O四种元素)的组成和性质,设计并完成了如下实 2020-11-05 …
某学生利用C、N、O三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所 2020-12-22 …
硫是一种生命元素,组成某些蛋白质时离不开它.SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴 2020-12-24 …