早教吧作业答案频道 -->化学-->
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如
题目详情
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险.因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质.
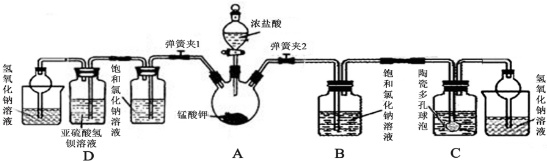
(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶.反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:___
(2)该小组利用装置C吸收氯气制备漂白粉.
①C中盛装的试剂为___
②陶瓷多孔球泡的作用是___
(3)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/LKI溶液进行滴定,三次平行实验平均每次消耗20.00ml标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为___,达到滴定终点的标志是___
②该漂白粉中有效成分的质量分数为___
(4)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为___,
该现象能够证明氯气有氧化性.甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由___.中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险.因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质.

(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶.反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:___
(2)该小组利用装置C吸收氯气制备漂白粉.
①C中盛装的试剂为___
②陶瓷多孔球泡的作用是___
(3)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/LKI溶液进行滴定,三次平行实验平均每次消耗20.00ml标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为___,达到滴定终点的标志是___
②该漂白粉中有效成分的质量分数为___
(4)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为___,
该现象能够证明氯气有氧化性.甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由___.24

---3-3--2-2

(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶.反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:___
(2)该小组利用装置C吸收氯气制备漂白粉.
①C中盛装的试剂为___
②陶瓷多孔球泡的作用是___
(3)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/LKI溶液进行滴定,三次平行实验平均每次消耗20.00ml标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为___,达到滴定终点的标志是___
②该漂白粉中有效成分的质量分数为___
(4)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为___,
该现象能够证明氯气有氧化性.甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由___.中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险.因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质.

(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶.反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:___
(2)该小组利用装置C吸收氯气制备漂白粉.
①C中盛装的试剂为___
②陶瓷多孔球泡的作用是___
(3)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/LKI溶液进行滴定,三次平行实验平均每次消耗20.00ml标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为___,达到滴定终点的标志是___
②该漂白粉中有效成分的质量分数为___
(4)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为___,
该现象能够证明氯气有氧化性.甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由___.24

---3-3--2-2
▼优质解答
答案和解析
A装置产生氯气,饱和氯化钠溶液的作用是吸收氯气中的氯化氢气体,并降低氯气在水中的溶解度,C是制备漂白粉,D是验证氯气具有氧化性,氢氧化钠是吸收尾气,据此分析.
(1)锰酸钾(K22MnO44)具有强氧化性,与浓盐酸反应观察到烧瓶壁有紫红色物质生成,该物质为高锰酸钾,锰元素的化合价在升高,根据K22MnO44中的化合价为+6价,处于中间价态,推测出在反应中既作氧化剂又作还原剂,再结合烧瓶内有黑色固体残余,联想到二氧化锰写出反应方程式为:3K22MnO44+4HCl(浓盐酸)=2KMnO44+4KCl+MnO22+2H22O;第二个反应是高锰酸钾与浓盐酸反应产生氯气、氯化锰、氯化钾、水,方程式为:2KMnO44+16HCl(浓)═2KCl+2MnCl22+5Cl22↑+8H22O,
故答案为:3K22MnO44+4HCl(浓盐酸)=2KMnO44+4KCl+MnO22+2H22O,2KMnO44+16HCl(浓)═2KCl+2MnCl22+5Cl22↑+8H22O;
(2)①用石灰乳与氯气制备漂白粉,
故答案为:石灰乳;
②陶瓷多孔球泡的作用是增大气体接触面积,使氯气吸收更充分,
故答案为:增大气体接触面积,使氯气吸收更充分;
(3)①反应产物有碘单质生成,用淀粉作指示剂,最后一滴标准液滴下时,溶液变为浅蓝色,振荡半分钟不褪色,则达到终点,
故答案为:淀粉;最后一滴标准液滴下时,溶液变为浅蓝色,振荡半分钟不褪色;
②先根据反应离子方程式确定出ClO--与I--的关系,
3ClO--+I--=3Cl--+IO33--①;IO33--+5I--+3H22O=6OH--+3I22②
将方程式①+②得:ClO--+2I--+H22O=Cl--+2OH--+I22
每次实验消耗KI溶液的体积为20.00mL,设次氯酸根离子的物质的量为x,
ClO--+2I--+H22O=Cl--+2OH--+I22
1mol 2mol
x 0.1000mol•L-1-1×0.020L
所以x=0.001mol
每次实验次氯酸钙的质量为:143g/mol×0.001mol×0.5=0.0715g,三次实验总质量为0.0715g×3=0.2145g,
所以质量分数为:
×100%=14.3%,
故答案为:14.3%;
(4)打开分液漏斗活塞及弹簧夹1,氯气将亚硫酸氢钡氧化成硫酸钡沉淀;取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,不能证明氯气氧化了亚硫酸氢钡,因为氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物,
故答案为:出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物.
0.2145g 1.5g 0.2145g 0.2145g 0.2145g1.5g 1.5g 1.5g×100%=14.3%,
故答案为:14.3%;
(4)打开分液漏斗活塞及弹簧夹1,氯气将亚硫酸氢钡氧化成硫酸钡沉淀;取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,不能证明氯气氧化了亚硫酸氢钡,因为氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物,
故答案为:出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物.
(1)锰酸钾(K22MnO44)具有强氧化性,与浓盐酸反应观察到烧瓶壁有紫红色物质生成,该物质为高锰酸钾,锰元素的化合价在升高,根据K22MnO44中的化合价为+6价,处于中间价态,推测出在反应中既作氧化剂又作还原剂,再结合烧瓶内有黑色固体残余,联想到二氧化锰写出反应方程式为:3K22MnO44+4HCl(浓盐酸)=2KMnO44+4KCl+MnO22+2H22O;第二个反应是高锰酸钾与浓盐酸反应产生氯气、氯化锰、氯化钾、水,方程式为:2KMnO44+16HCl(浓)═2KCl+2MnCl22+5Cl22↑+8H22O,
故答案为:3K22MnO44+4HCl(浓盐酸)=2KMnO44+4KCl+MnO22+2H22O,2KMnO44+16HCl(浓)═2KCl+2MnCl22+5Cl22↑+8H22O;
(2)①用石灰乳与氯气制备漂白粉,
故答案为:石灰乳;
②陶瓷多孔球泡的作用是增大气体接触面积,使氯气吸收更充分,
故答案为:增大气体接触面积,使氯气吸收更充分;
(3)①反应产物有碘单质生成,用淀粉作指示剂,最后一滴标准液滴下时,溶液变为浅蓝色,振荡半分钟不褪色,则达到终点,
故答案为:淀粉;最后一滴标准液滴下时,溶液变为浅蓝色,振荡半分钟不褪色;
②先根据反应离子方程式确定出ClO--与I--的关系,
3ClO--+I--=3Cl--+IO33--①;IO33--+5I--+3H22O=6OH--+3I22②
将方程式①+②得:ClO--+2I--+H22O=Cl--+2OH--+I22
每次实验消耗KI溶液的体积为20.00mL,设次氯酸根离子的物质的量为x,
ClO--+2I--+H22O=Cl--+2OH--+I22
1mol 2mol
x 0.1000mol•L-1-1×0.020L
所以x=0.001mol
每次实验次氯酸钙的质量为:143g/mol×0.001mol×0.5=0.0715g,三次实验总质量为0.0715g×3=0.2145g,
所以质量分数为:
| 0.2145g |
| 1.5g |
故答案为:14.3%;
(4)打开分液漏斗活塞及弹簧夹1,氯气将亚硫酸氢钡氧化成硫酸钡沉淀;取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,不能证明氯气氧化了亚硫酸氢钡,因为氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物,
故答案为:出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物.
| 0.2145g |
| 1.5g |
故答案为:14.3%;
(4)打开分液漏斗活塞及弹簧夹1,氯气将亚硫酸氢钡氧化成硫酸钡沉淀;取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,不能证明氯气氧化了亚硫酸氢钡,因为氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物,
故答案为:出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物.
看了 中学常采用高锰酸钾加热分解法...的网友还看了以下:
如图已知经过原点的抛物线y=ax2+bx(a不等于0)经过A(-2,2),B(6,6)两点已知过原 2020-05-23 …
如何利用杠杆原理测量待测物体质量(例如硬币)大神们帮帮忙要求:在硬币质量未知情况下如何测出待测物体 2020-06-07 …
已知氧化还原反应发生的条件是:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物.又已知还原性强弱 2020-06-19 …
如何判断是还原产物还是氧化产物?在化学反应中,若知道某物为还原剂或氧化剂,那如何判断生成物中哪个是 2020-06-30 …
已知有机物分子中羰基可跟H—CN发生加成反应,如:+HCN→生成物中的一CN基在酸性条件下可水解生 2020-07-19 …
请论证对于知识或事物知道它比喜欢它更重要希望能举一些具体例子,比如***原本并不喜欢什么,但他却去了 2020-11-27 …
从植物病害组织中如何提取病原物的DNA?如何将提取的病原物DNA与寄主DNA相区别?如果病害组织中有 2020-12-20 …
从植物病害组织中如何提取病原物的DNA?如何将提取的病原物DNA与寄主DNA相区别?如果病害组织中有 2020-12-20 …
烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.如图1是以A为原料合成药物中间体E和 2020-12-22 …
忍冬花又名金银花,其有效活性成分具有广泛的杀菌消炎功效,结构如图所示,下列有关该有机物的说法正确的是 2021-01-08 …