早教吧作业答案频道 -->化学-->
KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.(1)在K2MnO4溶液中通入CO2可制得KMnO4,副产物是黑色沉淀M.该反应中氧化剂与还原剂的质量之比为.由锂离子有机高聚物、锂
题目详情
KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.
(1)在K2MnO4溶液中通入CO2可制得KMnO4,副产物是黑色沉淀M.该反应中氧化
剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,
电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应
为___.
(2)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁片作阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如图:
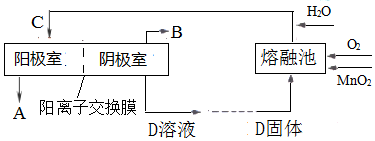
则D的化学式为___;阳极的电极反应式为___.
(3)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到a mol
O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L.KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.
(1)在K2MnO4溶液中通入CO2可制得KMnO4,副产物是黑色沉淀M.该反应中氧化
剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,
电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应
为___.
(2)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁片作阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如图:

则D的化学式为___;阳极的电极反应式为___.
(3)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到a mol
O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L.4
2424
244224244

4224
222+2
(1)在K2MnO4溶液中通入CO2可制得KMnO4,副产物是黑色沉淀M.该反应中氧化
剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,
电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应
为___.
(2)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁片作阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如图:

则D的化学式为___;阳极的电极反应式为___.
(3)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到a mol
O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L.KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.
(1)在K2MnO4溶液中通入CO2可制得KMnO4,副产物是黑色沉淀M.该反应中氧化
剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,
电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应
为___.
(2)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁片作阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如图:

则D的化学式为___;阳极的电极反应式为___.
(3)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到a mol
O2,在反应后的残留固体中加入足量浓盐酸,加热又收集到b mol Cl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L.4
2424
244224244

4224
222+2
▼优质解答
答案和解析
(1)反应物为K22MnO44、CO22、生成黑色固体MnO22、KMnO44,所以的化学方程式为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;由化学反应方程式:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33分析得出,3molK22MnO44参加反应生成2molKMnO44、1molMnO22,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;锂离子有机高聚物、锂及MnO22构成原电池,正极上发生得电子的还原反应,电极反应式为:MnO22+e--+Li++=LiMnO22,
故答案为:1:2;MnO22+e--+Li++=LiMnO22;
(2)根据信息:软锰矿(主要成分是MnO22)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K22MnO44来书写方程式为:2MnO22+4KOH+O22
2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,即MnO42--e-=MnO4-,
故答案为:2MnO2+4KOH+O2
2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
△ △ △ △ 2K22MnO44+2H22O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H22O+2e--═H22↑+2OH--,D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO442-2--2e--═2MnO44--,即MnO442-2--e--=MnO44--,
故答案为:2MnO22+4KOH+O22
2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
△ △ △ △ 2K22MnO44+2H22O;KOH;MnO442-2--e--=MnO44--;
(3)KMnO44固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl22的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
故答案为:1:2;MnO22+e--+Li++=LiMnO22;
(2)根据信息:软锰矿(主要成分是MnO22)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K22MnO44来书写方程式为:2MnO22+4KOH+O22
| ||
故答案为:2MnO2+4KOH+O2
| ||
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:2MnO22+4KOH+O22
| ||
(3)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(3)KMnO44固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl22的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44.
看了 KMnO4常用作氧化剂、防腐...的网友还看了以下:
某“塑化剂”的化学式为C24H34O4,下列说法正确的是()A.该“塑化剂”不属于有机高分子化合物 2020-04-08 …
据报道,美国已经找到名为Trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨.该催化剂的作用是 2020-04-11 …
一氧化碳和水反应的催化剂是什么?RT.再说一句,告诉我不反应的菜菜就不要留言了.还有,说出该催化剂 2020-05-12 …
据报道,美国俄亥冈大学的化学家已经找到名为trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨 2020-05-13 …
某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许 2020-07-01 …
据报道,美国俄亥冈大学的化学家已经找到名为trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨 2020-07-12 …
据报道,美国俄亥冈大学的化学家已经找到名为trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨 2020-07-12 …
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.(1)CoxNi(1-x)Fe2O4(其中 2020-11-01 …
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.(1)CoxNi(1-x)Fe2O4(其中 2020-11-01 …
有媒体报到,市面上部分方便面遭到塑化剂污染,长期接触塑化剂可损害血液系统和生殖系统.塑化剂(DMP) 2020-12-31 …