早教吧作业答案频道 -->化学-->
发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂.(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1已知反应相关的化学键键能数据如表:化学键N-
题目详情
发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂.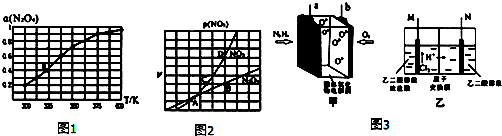
(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
则使l mol N2O4(1)分子中化学键完全断裂时需要吸收的能量是___
(2)N2O4与NO2之间存在反应N2O4(g)⇌2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H___0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有___(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___,在图标出的点中,能表示反应达到平衡状态的点为___.
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为___.
②a极与___(填“M”或“N”)相连,写出N极电极反应式___.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为___mol.

(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2之间存在反应N2O4(g)⇌2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H___0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有___(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___,在图标出的点中,能表示反应达到平衡状态的点为___.
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为___.
②a极与___(填“M”或“N”)相连,写出N极电极反应式___.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为___mol.
▼优质解答
答案和解析
(1)设1mol N2O4(1)完全分解成相应的原子时需要吸收的能量QKJ,则:
190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,
解得Q=1793,故答案为:1793kJ;
(2)①根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,若要提高N2O4转化率,除改变反应温度外,其他措施有减小体系压强、移出NO2,
故答案为:>;减小体系压强、移出NO2;
②四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=
=151.2KPa,
四氧化二氮的分压=151.2KPa×
=64.8KPa,
二氧化氮的分压=151.2KPa×
=86.4KPa,
化学平衡常数K=
=
=115.2,
故答案为:115.2;
③化学平衡常数Kp=[p(NO2)]2÷p(N2O4),二者的反应速率之比等于其计量数之比,
所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1•p(N2O4)=2:1,
化学平衡常数Kp=[p(NO2)]2÷p(N2O4),
则K1=
K2.Kp,
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,BD点的压强之比等于其反应速率之比为1:2,所以BD为平衡点,
故答案为:
K2.Kp;B点与D点;
(3)①燃料作负极,发生氧化反应,电极反应式为N2H4+2O2-4e-=N2+2H2O,故答案为:N2H4+2O2-4e-=N2+2H2O;
②根据图知,a极为负极,M电极上有氯气生成,说明M电极上氯离子放电生成氯气,则M为阳极、N为阴极,负极与阴极相连,N电极上乙二酸得电子和氢离子反应生成乙醛酸,电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故答案为:N;HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
③若有2molH+通过质子交换膜,并完全参与了反应,根据HOOC-COOH+2e-+2H+═HOOC-CHO+H2O知右边装置有1mol乙醛酸生成,M电极附近发生的反应方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,有1.5mol氢离子生成时同时生成乙醛酸0.75mol,所以若有1.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为1.5mol,故答案为:1.5.
190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,
解得Q=1793,故答案为:1793kJ;
(2)①根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,若要提高N2O4转化率,除改变反应温度外,其他措施有减小体系压强、移出NO2,
故答案为:>;减小体系压强、移出NO2;
②四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=
| 108KPa |
| xmol |
四氧化二氮的分压=151.2KPa×
| 0.6xmol |
| 1.4xmol |
二氧化氮的分压=151.2KPa×
| 0.8xmol |
| 1.4xmol |
化学平衡常数K=
| 生成物分压幂之积 |
| 反应物分压幂之积 |
| 86.42 |
| 64.8 |
故答案为:115.2;
③化学平衡常数Kp=[p(NO2)]2÷p(N2O4),二者的反应速率之比等于其计量数之比,
所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1•p(N2O4)=2:1,
化学平衡常数Kp=[p(NO2)]2÷p(N2O4),
则K1=
| 1 |
| 2 |
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,BD点的压强之比等于其反应速率之比为1:2,所以BD为平衡点,
故答案为:
| 1 |
| 2 |
(3)①燃料作负极,发生氧化反应,电极反应式为N2H4+2O2-4e-=N2+2H2O,故答案为:N2H4+2O2-4e-=N2+2H2O;
②根据图知,a极为负极,M电极上有氯气生成,说明M电极上氯离子放电生成氯气,则M为阳极、N为阴极,负极与阴极相连,N电极上乙二酸得电子和氢离子反应生成乙醛酸,电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故答案为:N;HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
③若有2molH+通过质子交换膜,并完全参与了反应,根据HOOC-COOH+2e-+2H+═HOOC-CHO+H2O知右边装置有1mol乙醛酸生成,M电极附近发生的反应方程式为Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl,有1.5mol氢离子生成时同时生成乙醛酸0.75mol,所以若有1.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为1.5mol,故答案为:1.5.
看了 发射航天火箭常用肼(N2H4...的网友还看了以下:
关于sp2sp3杂化的问题(一)比如NO2-分子中心N应该是6电子采取sp2杂化那应该是(1)N给每 2020-03-30 …
对于化学方程式C+O CO2表示的意义,叙述正确的是( ) A 、碳加氧气等于二氧化碳 B 、一 2020-05-14 …
关于化合价的问题,O的化合价为-2,是不是也就是说在O在反应中要得到两个负电荷?和O反应的那种物质 2020-05-20 …
下列对IPv6地址FE01:O:O:050D:23:O:O:03D4的简化表示中,错误的是( )。A 2020-05-23 …
高手在2H₂+O₂点燃=2H₂O的反应中,反应前后肯定发生改变的是在2H₂+O₂点燃=2H₂O的反 2020-06-04 …
木炭、一氧化碳在一定条件下都能与CuO发生反应,下列叙述正确的是()A.反应中C、CO都得到氧,发 2020-06-23 …
(2003•南通)木炭、一氧化碳在一定条件下都能与CuO发生反应,下列叙述正确的是()A.反应中C 2020-06-23 …
如图是利用缺铁性氧化物[Fe(1-y)O]进行CO2再资源化研究的示意图.在整个转化体系中Fe(1- 2020-11-04 …
为何不用含O-18的乙酸探究酯化反应的机理,必须用O-18的乙醇探究酯化反应的机理? 2020-11-21 …
诺贝尔化学奖的成果之一是对CO催化过程的研究诺贝尔化学奖的成果之一是对CO催化氧化过程的研究,即一氧 2021-02-19 …