早教吧作业答案频道 -->化学-->
无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定
题目详情
无水硫酸亚铁是一种白色粉末,其水溶液为浅绿色.常见其七水化合物晶体,俗称绿矾(FeSO4•7H2O),主要用于净水、照相制版及在医药上作补血剂治疗缺铁性贫血等.某课外小组为了测定某补血剂中铁元素的含量,进行了如下实验:
【查阅资料】
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是Fe2++MnO4-+H+
①
+H+→Fe3++Mn2+ (未配平)
【实验步骤】
称取0.790gKMnO4晶体,配成500.00mL水溶液;(已知Mr(KMnO4)=158)
②取除去糖衣(不与强氧化剂反应)后的硫酸亚铁补血剂药片(1.500g),研细后加稀硫酸溶解,配成100.00mL水溶液;
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中;
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积初始读数;
⑤滴定,并记录 KMnO4标准溶液的终点读数,再重复滴定2次.
【实验记录】
【交流与讨论】
(1)书写完整并配平离子反应___Fe2++___MnO4-+___H+→___Fe3++___Mn2++______.
(2)配制KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___(填仪器名称).
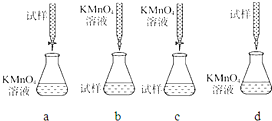
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是___(填字母序号).
(4)下列有关实验操作的描述及分析正确的是___(填字母序号).
A.配制KMnO4溶液时容量瓶洗涤后不需干燥即可直接用于实验
B.滴定过程中当观察到溶液颜色发生变化时应立即停止滴加,防止滴加过量
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着滴定管中读数变化
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则会使所测得的补血剂中铁元素的含量偏低
(5)根据实验数据,计算步骤②中所配制的硫酸亚铁溶液的浓度为___,该补血剂中铁元素的质量分数为___.(浓度计算结果保留四位有效数字)
【查阅资料】
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是Fe2++MnO4-+H+
①
| MnO | - 4 |
【实验步骤】
称取0.790gKMnO4晶体,配成500.00mL水溶液;(已知Mr(KMnO4)=158)
②取除去糖衣(不与强氧化剂反应)后的硫酸亚铁补血剂药片(1.500g),研细后加稀硫酸溶解,配成100.00mL水溶液;
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中;
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积初始读数;
⑤滴定,并记录 KMnO4标准溶液的终点读数,再重复滴定2次.
【实验记录】
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL (初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL (终读数) | 15.85 | 15.22 | 14.98 |

(1)书写完整并配平离子反应___Fe2++___MnO4-+___H+→___Fe3++___Mn2++______.
(2)配制KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___(填仪器名称).
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是___(填字母序号).
(4)下列有关实验操作的描述及分析正确的是___(填字母序号).
A.配制KMnO4溶液时容量瓶洗涤后不需干燥即可直接用于实验
B.滴定过程中当观察到溶液颜色发生变化时应立即停止滴加,防止滴加过量
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着滴定管中读数变化
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则会使所测得的补血剂中铁元素的含量偏低
(5)根据实验数据,计算步骤②中所配制的硫酸亚铁溶液的浓度为___,该补血剂中铁元素的质量分数为___.(浓度计算结果保留四位有效数字)
▼优质解答
答案和解析
(1)根据根据反应可知,铁从+2价升到+3价,锰从+7价降为+2价,根据化合价升降法及电荷守恒配平离子方程式为5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
故答案为:5;1;8;5;1;4H2O;
(2)配制一定物质的量浓度的KMnO4溶液,所用的仪器有天平、药匙、烧杯、玻璃棒、500mL 容量瓶、胶体滴管,
故答案为:500mL 容量瓶、胶体滴管;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,所以应把高锰酸钾滴入试样中,所以应用c图装置,故选c;
(4)A.配制KMnO4溶液时容量瓶洗涤后不需干燥对实验没有影响,故A正确;
B.滴定过程中当观察到溶液颜色发生变化且保持30s不变时才应停止滴加,故B错误;
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着锥形瓶中溶液的颜色变化,故C错误;
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,对实验结果没有影响,故D错误,
故选A;
(5)滴定中由于第一组数据误差较大,应舍去,滴定中用掉高锰酸钾溶液的体积为
×(15.02+14.98)mL=15.0OmL,高锰酸钾的物质的量为
×
mol=1.50×10-4 mol,根据反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O可知,20.00mL试样中硫酸亚铁的物质的量为7.5×10-4 mol,所以硫酸亚铁溶液的浓度为
mol/L=0.0375mol/L,该补血剂中铁元素的质量分数为
×100%=14%,
故答案为:0.0375mol/L;14%.
故答案为:5;1;8;5;1;4H2O;
(2)配制一定物质的量浓度的KMnO4溶液,所用的仪器有天平、药匙、烧杯、玻璃棒、500mL 容量瓶、胶体滴管,
故答案为:500mL 容量瓶、胶体滴管;
(3)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,所以应把高锰酸钾滴入试样中,所以应用c图装置,故选c;
(4)A.配制KMnO4溶液时容量瓶洗涤后不需干燥对实验没有影响,故A正确;
B.滴定过程中当观察到溶液颜色发生变化且保持30s不变时才应停止滴加,故B错误;
C.滴定过程中,左手控制滴定管,右手摇动锥形瓶,眼睛时刻关注着锥形瓶中溶液的颜色变化,故C错误;
D.若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,对实验结果没有影响,故D错误,
故选A;
(5)滴定中由于第一组数据误差较大,应舍去,滴定中用掉高锰酸钾溶液的体积为
| 1 |
| 2 |
| 0.79 |
| 158 |
| 15.0 |
| 500 |
| 7.5×10 -4 |
| 0.02 |
| 7.5×10 -4×56 | ||
1.500×
|
故答案为:0.0375mol/L;14%.
看了 无水硫酸亚铁是一种白色粉末,...的网友还看了以下:
连字成词(英语)l u o e b s r u s r e t o s w a e s r t e 2020-05-14 …
30之前给我答复,)一个数n的数字中为奇数的那些数字的和记为S(n),为偶数的那些数字的和记为E( 2020-06-05 …
称取1.4210g明矾试样,经化学反应后生成Al(OH)3,经灼烧生成Al2O3,质量为0.141 2020-06-11 …
称取1.4210g明矾试样,经化学反应后生成Al(OH)3,经灼烧生成Al2O3,质量为0.141 2020-06-11 …
《梦溪笔谈》中记载有:信州铅山县有苦泉,流以为涧.挹其水熬之,则成胆矾.烹胆矾则成铜;熬胆矾铁釜, 2020-06-19 …
32个罗经点每个点怎么读出来?罗经中的32个罗经点(N.N/E.NNE.NE/N.NE.NE/EE 2020-06-19 …
我国宋代《梦溪笔谈》记载的有关科学知识中有255条科技史实.部分如下:①信州铅山县有苦泉,流以为涧 2020-06-21 …
我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾.熬胆矾铁釜,久之 2020-07-06 …
铁棒的一端靠近条形磁铁的S极,发现两者相互排斥,则铁棒原来()A.一定有磁性,接近磁铁S极的一端为S 2020-11-01 …
英语:下1.将下联打乱的字母组成单词,并写出汉语意思1.a,e,h,g,c,n[]2.e,i,s,t 2020-12-10 …