早教吧作业答案频道 -->化学-->
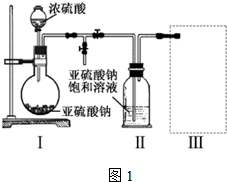
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一焦亚硫酸钠的制取采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有Na2S2O5晶体析出,
题目详情
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置 II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2═Na2S2O5
(1)装置 I中产生气体的化学方程式为___.
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是___.
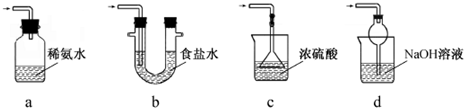
(3)装置 III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___.(填序号).
实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为SO2+I2+2H2O═H2SO4+2HI)在测定时消耗了0.01mol•L-1的I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g•L-1.在上述实验过程中,若有部分HI被空气氧化,则测得结果___(填“偏高”“偏低”或“不变”).

实验一焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置 II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2═Na2S2O5
(1)装置 I中产生气体的化学方程式为___.
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是___.
(3)装置 III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___.(填序号).

实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为SO2+I2+2H2O═H2SO4+2HI)在测定时消耗了0.01mol•L-1的I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g•L-1.在上述实验过程中,若有部分HI被空气氧化,则测得结果___(填“偏高”“偏低”或“不变”).
▼优质解答
答案和解析
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
=0.16 g/L,
若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:0.16;偏低.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
| 0.016g |
| 0.1L |
若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:0.16;偏低.
看了 焦亚硫酸钠(Na2S2O5)...的网友还看了以下:
为什么某些英语单词中s和z都可以?比如:“文明”就civilisation和civilizatio 2020-05-13 …
请问:外面卖的珍珠奶茶用的包装塑料瓶子是PET吗?外面卖的珍珠奶茶,用的包装瓶子,细管,用的是什么 2020-05-16 …
路灯的常用高度是多少?常用的安装间距是多少?材质?常用的光源是哪种?光源的功率是多少? 2020-05-17 …
英语翻译这是手扳压机用的工装上的一个零件.不是机床上的零件,是工装上的,手板压机上手动铆接时候用的 2020-05-22 …
均速管流量计采用的安装方式有( )、法兰式.A.卡套式B.插入式C.焊接式D.对夹式 2020-05-31 …
包装三和磁带,每盒长10厘米,宽6.5厘米,厚1.5厘米.请你设计一种最节约的包装方式,使用的包装 2020-06-03 …
某塔类设备需安装在高基础上时,其采用的吊装方法应为( )。 A.直立单桅杆滑移法 B.斜立单 2020-06-07 …
有一周边支承的大型钢网架,施工场地狭窄,地面整体拼装后可采用的吊装方法是( )。 A.顶升 2020-06-07 …
(2014•莱芜)“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化 2020-06-16 …
某商品外包装盒上的标签如图所示,从它提供的信息中,你能知道该商品所用的包装盒的质量和体积分别是多少 2020-06-20 …