早教吧作业答案频道 -->化学-->
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一、焦亚硫酸钠的制取采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有Na2S2O5晶体析出
题目详情
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
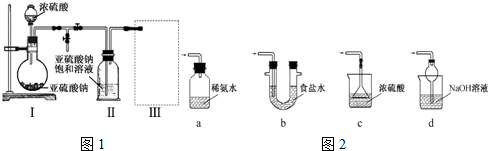
实验一、焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置I滴加浓硫酸的玻璃仪器名称:___;发生反应的玻璃仪器名称是___;其中产生气体的化学方程式为___.
(2)装置III用于处理尾气,可选用的最合理装置如图2(夹持仪器已略去)为___(填序号).
实验二、焦亚硫酸钠的性质
已知Na2S2O5溶于水即生成NaHSO3;
(3)NaHSO3溶液中HSO3-的电离程度大于次氯酸,请写出两者混合时的离子方程式:___;
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三、葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,滴定终点的现象是:___;消耗标准I2溶液100.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g/L.
②上述实验中,若有部分HI被空气氧化,则测定结果___(填“偏高”“偏低”或“不变”).

实验一、焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置I滴加浓硫酸的玻璃仪器名称:___;发生反应的玻璃仪器名称是___;其中产生气体的化学方程式为___.
(2)装置III用于处理尾气,可选用的最合理装置如图2(夹持仪器已略去)为___(填序号).
实验二、焦亚硫酸钠的性质
已知Na2S2O5溶于水即生成NaHSO3;
(3)NaHSO3溶液中HSO3-的电离程度大于次氯酸,请写出两者混合时的离子方程式:___;
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三、葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,滴定终点的现象是:___;消耗标准I2溶液100.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g/L.
②上述实验中,若有部分HI被空气氧化,则测定结果___(填“偏高”“偏低”或“不变”).
▼优质解答
答案和解析
(1)a仪器的名称为分液漏斗,发生反应的玻璃仪器名称为圆底烧瓶;装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:分液漏斗;圆底烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)处理过量的SO2尾气,a项装置瓶口封闭,错误;b项食盐水不能将大量的SO2尾气吸收,错误;c项漏斗口没入了液体中,错误,d项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确;
故答案为:d;
(3)次氯酸具有强氧化性,能氧化亚硫酸氢根离子为硫酸,反应的离子方程式HSO3-+HClO=SO42-+Cl-+2 H+,
故答案为:HSO3-+HClO=SO42-+Cl-+2 H+;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量焦亚硫酸钠晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成;
(5)①碘单质滴定,滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI,所以滴定终点为溶液变化为蓝色且半分钟不褪色,
令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.1L×0.01mol/L
所以,64g:mg=1mol:0.1L×0.01mol/L,
解得m=6.4g
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
=0.64 g/L
故答案为:当滴入最后一滴标准液时,溶液显蓝色,且半分钟不退色;0.64;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,故答案为:偏低.
故答案为:分液漏斗;圆底烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)处理过量的SO2尾气,a项装置瓶口封闭,错误;b项食盐水不能将大量的SO2尾气吸收,错误;c项漏斗口没入了液体中,错误,d项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确;
故答案为:d;
(3)次氯酸具有强氧化性,能氧化亚硫酸氢根离子为硫酸,反应的离子方程式HSO3-+HClO=SO42-+Cl-+2 H+,
故答案为:HSO3-+HClO=SO42-+Cl-+2 H+;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量焦亚硫酸钠晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成;
(5)①碘单质滴定,滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI,所以滴定终点为溶液变化为蓝色且半分钟不褪色,
令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.1L×0.01mol/L
所以,64g:mg=1mol:0.1L×0.01mol/L,
解得m=6.4g
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
| 6.4g |
| 0.1L |
故答案为:当滴入最后一滴标准液时,溶液显蓝色,且半分钟不退色;0.64;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,故答案为:偏低.
看了 焦亚硫酸钠(Na2S2O5)...的网友还看了以下:
1.小方6分之1行2千米,她每小时行多少千米?2.小明的体重是42又2分之1,正好是李老师体重的6 2020-04-07 …
1.小方6分之1行2千米,每小时行多少千米?2.小明的体重是42又2分之1,正好是李老师体重的6分 2020-04-07 …
有一列数:1,2分之1,2分之1,3分之1,3分之1,3分之1,4分之1,4分之1,4分之1,4分 2020-05-16 …
鲸的体重约是30000kg,一只非洲象的体重是他的5分之1,一只成年海报的体重是非洲象的20分之1 2020-05-16 …
明治天皇在《征兵告谕》中指出:“世袭坐食之士,减其俸禄,许脱刀剑”,“至是,则士非往昔之士,民非从 2020-05-16 …
一个长方体的长与一个正方体的棱长相等,已知长方体的宽是2又3分之1分米,高是1.体积是10.5立方 2020-05-17 …
有一个长方形的长、宽、高之比为1比2分之1比3分之1,如果沿宽边摆棱长为2厘米的小正方体的话,可以 2020-05-21 …
埃及最大金字塔,由于受风雨侵蚀,现在的高度只有140M,比建成时低了二十一分之1,金字塔建成是多高 2020-06-19 …
若数列an的通项为an等于n乘n加一分之1,求其前100项的和s100 2020-07-16 …
√20又4分之1-3分之1*√0.36-5分之1*√100等一些题,下面有.(1)√20又4分之1 2020-07-16 …