早教吧作业答案频道 -->化学-->
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.A是元素周期表中原子半径最小的元素,非金属元素B原子的核外电子数是未成对电子数的3倍,C原子的最外层p轨道的电
题目详情
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.A是元素周期表中原子半径最小的元素,非金属元素B原子的核外电子数是未成对电子数的3倍,C原子的最外层p轨道的电子为半充满结构,D是地壳中含量最多的元素.E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同.回答下列问题:
(1)E的基态原子价电子排布图___.
(2)B、C、D的第一电离能由小到大的顺序为___.(用元素符号表示)
(3)CA3物质能与很多化合物通过配位键发生相互作用.CA3与第2周期中的另一种元素的氢化物相互作用得到的化合物X是科学家潜心研究的一种储氢原料,X是乙烷的等电子体;加热X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体.
①化合物CA3的分子空间构型为___,X的结构式为___(必须标明配位键).
②形成CA3物质的中心原子在X、Y分子中的杂化方式分别是___,Y分子中σ键和π键数目之比为___.
(4)在研究金矿床物质组分的过程中,通过分析发现了E元素存在E-Ni-Zn-Sn-Fe多金属互化物.
①某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或“非晶体”),可通过___方法鉴别.
②E能与类卤素(SCN)2反应生成E(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的沸点,其原因是___.
③立方NiO(氧化镍)晶体的结构与氯化钠相同,其中每个Ni周围有___个最近距离的氧原子,这些氧原子形成的空间构型为___,若NiO晶体的密度为ρg•cm-3,其晶胞边长为___cm(不必计算结果,阿伏加德罗常数常数的值为NA).
332
3
3
222
-3A
(1)E的基态原子价电子排布图___.
(2)B、C、D的第一电离能由小到大的顺序为___.(用元素符号表示)
(3)CA3物质能与很多化合物通过配位键发生相互作用.CA3与第2周期中的另一种元素的氢化物相互作用得到的化合物X是科学家潜心研究的一种储氢原料,X是乙烷的等电子体;加热X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体.
①化合物CA3的分子空间构型为___,X的结构式为___(必须标明配位键).
②形成CA3物质的中心原子在X、Y分子中的杂化方式分别是___,Y分子中σ键和π键数目之比为___.
(4)在研究金矿床物质组分的过程中,通过分析发现了E元素存在E-Ni-Zn-Sn-Fe多金属互化物.
①某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或“非晶体”),可通过___方法鉴别.
②E能与类卤素(SCN)2反应生成E(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的沸点,其原因是___.
③立方NiO(氧化镍)晶体的结构与氯化钠相同,其中每个Ni周围有___个最近距离的氧原子,这些氧原子形成的空间构型为___,若NiO晶体的密度为ρg•cm-3,其晶胞边长为___cm(不必计算结果,阿伏加德罗常数常数的值为NA).
332
3
3
222
-3A
▼优质解答
答案和解析
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大;A是元素周期表中原子半径最小的元素,则A为H元素;
非金属元素B原子的核外电子数是未成对电子数的3倍,则B是C元素;
D是地壳中含量最多的元素,则D为O元素,C原子的最外层p轨道的电子为半充满结构,且C原子序数大于B而小于D,所以C是N元素;
E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,为Cu元素;
(1)E是Cu元素,有29个电子,其3d、4s电子为Cu原子价电子,其价电子排布图为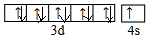 ,故答案为:
,故答案为: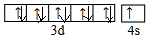 ;
;
(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①氨气分子中,NH33中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+
(5-3×1)=4,所以采取sp3杂化,空间构型是三角锥型;
NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH3•NH3,Y是乙烯的等电子体,应为BH2=NH2,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为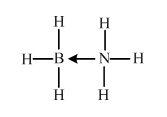 ,
,
故答案为:三角锥形; ;
;
②由 可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
故答案为:sp3和sp2;5:1;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别,某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,可通过X射线衍射方法鉴别,
故答案为:晶体;X射线衍射;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,晶胞中Ni原子数目为1+12×
=4,氧原子数目为8×
+6×
=4,晶胞体积=
cm3,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
1 2 1 1 12 2 2(5-3×1)=4,所以采取sp33杂化,空间构型是三角锥型;
NH33与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH33•NH33,Y是乙烯的等电子体,应为BH22=NH22,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为 ,
,
故答案为:三角锥形; ;
;
②由 可知,中心原子形成4个σ 键,为sp33杂化,Y是乙烯的等电子体,应为BH22=NH22,BH22=NH22中B和N都形成3个σ 键,为sp22杂化,BH22=NH22中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
可知,中心原子形成4个σ 键,为sp33杂化,Y是乙烯的等电子体,应为BH22=NH22,BH22=NH22中B和N都形成3个σ 键,为sp22杂化,BH22=NH22中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
故答案为:sp33和sp22;5:1;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别,某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,可通过X射线衍射方法鉴别,
故答案为:晶体;X射线衍射;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,晶胞中Ni原子数目为1+12×
=4,氧原子数目为8×
+6×
=4,晶胞体积=
cm3,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
1 4 1 1 14 4 4=4,氧原子数目为8×
+6×
=4,晶胞体积=
cm3,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
1 8 1 1 18 8 8+6×
=4,晶胞体积=
cm3,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
1 2 1 1 12 2 2=4,晶胞体积=
cm3,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
×4ρ
×4
×4
(59+16) NA (59+16) (59+16) (59+16)NA NA NAA×4ρ ρ ρcm33,棱长=
=
cm=
cm,
故答案为:6;正八面体;
.
3 V 3 V 3 3V V
cm=
cm,
故答案为:6;正八面体;
.
3
3
3 3
×4ρ
×4
×4
(59+16) NA (59+16) (59+16) (59+16)NA NA NAA×4ρ ρ ρ
cm,
故答案为:6;正八面体;
.
3
3
3 3
75×4 ρNA 75×4 75×4 75×4ρNA ρNA ρNAA
故答案为:6;正八面体;
.
3
3
3 3
75×4 ρNA 75×4 75×4 75×4ρNA ρNA ρNAA
非金属元素B原子的核外电子数是未成对电子数的3倍,则B是C元素;
D是地壳中含量最多的元素,则D为O元素,C原子的最外层p轨道的电子为半充满结构,且C原子序数大于B而小于D,所以C是N元素;
E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,为Cu元素;
(1)E是Cu元素,有29个电子,其3d、4s电子为Cu原子价电子,其价电子排布图为
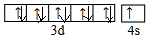 ,故答案为:
,故答案为: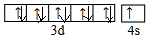 ;
;(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①氨气分子中,NH33中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+
| 1 |
| 2 |
NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH3•NH3,Y是乙烯的等电子体,应为BH2=NH2,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为
 ,
,故答案为:三角锥形;
 ;
; ②由
 可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,故答案为:sp3和sp2;5:1;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别,某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,可通过X射线衍射方法鉴别,
故答案为:晶体;X射线衍射;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,晶胞中Ni原子数目为1+12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ρ |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 1 |
| 2 |
NH33与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH33•NH33,Y是乙烯的等电子体,应为BH22=NH22,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为
 ,
,故答案为:三角锥形;
 ;
; ②由
 可知,中心原子形成4个σ 键,为sp33杂化,Y是乙烯的等电子体,应为BH22=NH22,BH22=NH22中B和N都形成3个σ 键,为sp22杂化,BH22=NH22中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
可知,中心原子形成4个σ 键,为sp33杂化,Y是乙烯的等电子体,应为BH22=NH22,BH22=NH22中B和N都形成3个σ 键,为sp22杂化,BH22=NH22中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,故答案为:sp33和sp22;5:1;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别,某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,可通过X射线衍射方法鉴别,
故答案为:晶体;X射线衍射;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,晶胞中Ni原子数目为1+12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ρ |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ρ |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ρ |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 1 |
| 2 |
| ||
| ρ |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| ||
| ρ |
| (59+16) |
| NA |
| (59+16) |
| NA |
| (59+16) |
| NA |
| (59+16) |
| NA |
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 3 | V |
| 3 |
| ||||
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 3 |
| ||||
| ||
| ρ |
| ||
| ρ |
| ||
| ρ |
| ||
| ρ |
| (59+16) |
| NA |
| (59+16) |
| NA |
| (59+16) |
| NA |
| (59+16) |
| NA |
| 3 |
| ||
故答案为:6;正八面体;
| 3 |
| ||
| 3 |
| ||
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
故答案为:6;正八面体;
| 3 |
| ||
| 3 |
| ||
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
| 75×4 |
| ρNA |
看了 A、B、C、D都是元素周期表...的网友还看了以下:
某运动鞋专卖店为了解初中生穿运动鞋的鞋号情况,对鞋店附近一所中学初二20名男生所穿鞋号统计如下表: 2020-04-07 …
请教数字的中文读法请问数字11111怎么读?一万一千一百一十一还是一万零一千一百一十一?刚刚在某处 2020-04-07 …
下列说法错误的是()A.一组数据的众数,中位数和平均数不可能是同一个数B.一组数据的平均数既不可能 2020-05-13 …
怎么比较函数值的中点和中点的函数值?高中一轮复习,超级困扰,老师说f((x1+x2)/2)是中点的 2020-06-15 …
123,21,24,25,24,26,35,37这八个数据的中位数是(),众数是().2一个最简真 2020-06-19 …
对于数据332363103632一这组数据的众数是三二这组数据的众数与中位数的数值对于数据3323 2020-06-25 …
(2014•昆都仑区一模)一组数据为:2,2,3,4,5,5,5,6,则下列说法正确的是()A.这 2020-07-02 …
2008年8月5日,奥运火炬在成都传递,其中8位火炬手所跑的路程(单位:米)如下:60,70,10 2020-07-03 …
下列说法中,正确的个数是()(1)一组数据的中位数只有一个.(2)一组数据的中位数可能是这组数据中 2020-07-16 …
海西物流公司总经理的月工资10000元,两个副总的月工资都是7000元,其他15名员工的月平均工资 2020-07-16 …