早教吧作业答案频道 -->化学-->
为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量.Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•
题目详情
为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量.
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1
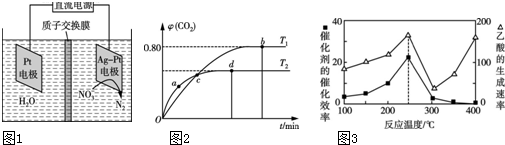
(1)若用4.48L CH4还原NO生成N2,则放出的热量为___kJ(保留两位小数).(气体体积已折算为标准状况下)
(2)用电化学处理含NO3-的废水,电解的原理如图1所示,则电解时阴极的电极反应式为___;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)⇌5CO2(g)+I2(s).不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示.
(3)T1时,该反应的化学平衡常数的数值为___.
(4)下列说法不正确的是___(填字母).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)⇌CH3COOH(g)△H<0直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示.
(5)250~300℃时,乙酸的生成速率减小的主要原因是___.为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量.
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1

(1)若用4.48L CH4还原NO生成N2,则放出的热量为___kJ(保留两位小数).(气体体积已折算为标准状况下)
(2)用电化学处理含NO3-的废水,电解的原理如图1所示,则电解时阴极的电极反应式为___;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)⇌5CO2(g)+I2(s).不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示.
(3)T1时,该反应的化学平衡常数的数值为___.
(4)下列说法不正确的是___(填字母).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)⇌CH3COOH(g)△H<0直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示.
(5)250~300℃时,乙酸的生成速率减小的主要原因是___.x2
xx
42221-1
422222-1

42
3-
252522252
1
bd
22424243
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1

(1)若用4.48L CH4还原NO生成N2,则放出的热量为___kJ(保留两位小数).(气体体积已折算为标准状况下)
(2)用电化学处理含NO3-的废水,电解的原理如图1所示,则电解时阴极的电极反应式为___;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)⇌5CO2(g)+I2(s).不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示.
(3)T1时,该反应的化学平衡常数的数值为___.
(4)下列说法不正确的是___(填字母).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)⇌CH3COOH(g)△H<0直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示.
(5)250~300℃时,乙酸的生成速率减小的主要原因是___.为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量.
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1

(1)若用4.48L CH4还原NO生成N2,则放出的热量为___kJ(保留两位小数).(气体体积已折算为标准状况下)
(2)用电化学处理含NO3-的废水,电解的原理如图1所示,则电解时阴极的电极反应式为___;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)⇌5CO2(g)+I2(s).不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示.
(3)T1时,该反应的化学平衡常数的数值为___.
(4)下列说法不正确的是___(填字母).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)⇌CH3COOH(g)△H<0直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示.
(5)250~300℃时,乙酸的生成速率减小的主要原因是___.x2
xx
42221-1
422222-1

42
3-
252522252
1
bd
22424243
▼优质解答
答案和解析
(1)①CH44(g)+4NO22(g)=4NO(g)+CO22(g)+2H22O(g)△H11=-574kJ•mol-1-1
②CH44(g)+2NO22(g)=N22(g)+CO22(g)+2H22O(g)△H22=-586.7kJ•mol-1-1
由盖斯定律②×2-①得到CH44(g)+4NO(g)═2N22(g)+CO22(g)+2H22O(g),所以焓变△H=(-586.7kJ•mol-1-1)×2-(-574kJ•mol-1-1)=-599.4kJ•mol-1-1,若用4.48L即0.2molCH44还原NO生成N22,则放出的热量为599.4kJ/mol×0.2mol=119.88kJ,
故答案为:119.88;
(2)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO33--+12H+++10e--=N22↑+6H22O,Pt电极为阳极,阳极反应为2H22O-4e--=O22+4H++,故答案为:2NO33--+12H+++10e--=N22↑+6H22O;
Ⅱ.(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO33--+12H+++10e--=N22↑+6H22O,Pt电极为阳极,阳极反应为2H22O-4e--=O22+4H++,当转移20mol电子时,阳极消耗10mol水,产生20molH++进入阴极室,阳极质量减少180g,
故答案为:2NO33--+12H+++10e--=N22↑+6H22O;180;
(4)T11时:5CO(g)+I22O55(s)⇌5CO22(g)+I22(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO22的体积分数φ(CO22)=
=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1,
T1时化学平衡常数K=
=
=1024,
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
y 4 y y y4 4 4=0.80,得y=3.2mol,c(CO)=0.4mol•L-1-1,c(CO22)=1.6mol•L-1-1,
T11时化学平衡常数K=
=
=1024,
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
c5(CO2) c5(CO) c5(CO2) c5(CO2) c5(CO2)5(CO2)2)c5(CO) c5(CO) c5(CO)5(CO)=
=1024,
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
1.65 0.45 1.65 1.65 1.6550.45 0.45 0.455=1024,
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO22体积分数大,说明进行的程度大,则化学平衡常数:Kbb>Kdd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
②CH44(g)+2NO22(g)=N22(g)+CO22(g)+2H22O(g)△H22=-586.7kJ•mol-1-1
由盖斯定律②×2-①得到CH44(g)+4NO(g)═2N22(g)+CO22(g)+2H22O(g),所以焓变△H=(-586.7kJ•mol-1-1)×2-(-574kJ•mol-1-1)=-599.4kJ•mol-1-1,若用4.48L即0.2molCH44还原NO生成N22,则放出的热量为599.4kJ/mol×0.2mol=119.88kJ,
故答案为:119.88;
(2)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO33--+12H+++10e--=N22↑+6H22O,Pt电极为阳极,阳极反应为2H22O-4e--=O22+4H++,故答案为:2NO33--+12H+++10e--=N22↑+6H22O;
Ⅱ.(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO33--+12H+++10e--=N22↑+6H22O,Pt电极为阳极,阳极反应为2H22O-4e--=O22+4H++,当转移20mol电子时,阳极消耗10mol水,产生20molH++进入阴极室,阳极质量减少180g,
故答案为:2NO33--+12H+++10e--=N22↑+6H22O;180;
(4)T11时:5CO(g)+I22O55(s)⇌5CO22(g)+I22(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO22的体积分数φ(CO22)=
| y |
| 4 |
T1时化学平衡常数K=
| c5(CO2) |
| c5(CO) |
| 1.65 |
| 0.45 |
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
| y |
| 4 |
T11时化学平衡常数K=
| c5(CO2) |
| c5(CO) |
| 1.65 |
| 0.45 |
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
| c5(CO2) |
| c5(CO) |
| 1.65 |
| 0.45 |
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
| 1.65 |
| 0.45 |
故答案为:1024;
(4)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO22体积分数大,说明进行的程度大,则化学平衡常数:Kbb>Kdd,故D错误;
故答案为:BD;
Ⅲ.(5)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低.
看了 为治理环境,减少雾霾,应采取...的网友还看了以下:
一个正方形的边长是30米,这个图形的周长是多少?面积又是多少?如果每4平方米种1棵苹果树,能种多少 2020-04-09 …
如图1,点O为直线AB上一点,过点O作射线OC,使∠BOC=120°.将一直角三角板的直角顶点放在 2020-05-16 …
(1)花坛的面积是多少?(2)这个花坛的周长是多少?(3)如果每平方米能栽4棵菊花,这个花坛一共可 2020-06-24 …
如图1是北京奥运场馆--国家游泳中心“水立方”.(1)“水立方”,它占地7.8公顷,由5个游泳区组 2020-07-20 …
如图1,点O为直线AB上一点,过点O作射线OC,使∠AOC:∠BOC=2:1,将直角三角板的直角顶 2020-07-24 …
如图1,点O为直线AB上一点,过点O作射线OC,使∠BOC=120°.将一直角三角板的直角顶点放在 2020-07-24 …
如图1,点O为直线AB上一点,过点O作射线OC,使∠AOC:∠BOC=2:1,将一直角三角板的直角 2020-07-24 …
已知圆M的圆心M在y轴上,半径为1.直线l:y=2x+2被圆M所截得的弦长为455,且圆心M在直线 2020-07-30 …
小明同学在教学楼上向下张望,楼下有一堵墙,小明想看到墙外的地方.(1)请你画出小明分别在A处、B处看 2020-11-10 …
图数表v的“1、1、9”三个数被三个连在一起的正方形圈住了,我们就把它叫做“三连方1、1、9”,用形 2020-11-17 …