早教吧作业答案频道 -->化学-->
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:4Fe
题目详情
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
4FeS2+11O2
2Fe2O3+8SO2,2SO2+O2
2SO3,
SO3+H2O═H2SO4.
回答下列问题:
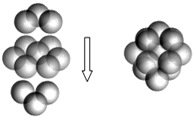
(1)在FeS2中的S2-的核外电子排布式是___;
(2)常温下Fe3+比Fe2+要更加稳定的原因是___;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是___,写出两个与SO2互为等电子体的分子或离子___.-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:___.
(5)FeS2的晶体中的Fe2+离子的排列方式如图.
①每个Fe2+周围最近的等距离的S22-离子有___个.
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为___g•cm-3(列式并计算,阿伏加德罗常数为6.02×1023).
4FeS2+11O2
| ||
| 400-500℃ |
| |
| 催化剂 |
SO3+H2O═H2SO4.
回答下列问题:

(1)在FeS2中的S2-的核外电子排布式是___;
(2)常温下Fe3+比Fe2+要更加稳定的原因是___;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是___,写出两个与SO2互为等电子体的分子或离子___.-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:___.
(5)FeS2的晶体中的Fe2+离子的排列方式如图.
①每个Fe2+周围最近的等距离的S22-离子有___个.
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为___g•cm-3(列式并计算,阿伏加德罗常数为6.02×1023).
▼优质解答
答案和解析
(1)在FeS2中的S2-是2个S原子得到1个电子形成的阴离子,故电子排布式为[Ar]3d6或1s22s22p63s23p63d6,故答案为:[Ar]3d6或1s22s22p63s23p63d6;(2)因为Fe3+的基态电子排布式为[Ar]3d5,各轨道电子均处于稳定状态...
看了 黄铁矿被称“愚人金”,化学成...的网友还看了以下:
一定量的盐酸与过量的锌粉反应,为了加快化学反应速率,但不影响最终产生氢气的总量,可以采用下列的(多选 2020-03-30 …
用铁丝围一个直径12厘米的铁环,如果接头处多用2厘米的铁丝.做这样一个铁环要用多长的铁丝! 2020-04-26 …
1.林叔叔用铁皮加工10个长0.8m,宽0.5m高5m的长方体烟囱,用了多少平方米的铁皮?2.用一 2020-06-02 …
用火烤过的磁铁与盐酸反应有没有更快一些?磁铁是用四氧化三铁做的,用火烤过后,磁铁磁性消失,这对它的 2020-07-12 …
Fe2+、Fe3+与O22-、CN-、F-、有机分子等形成的化合物具有广泛的应用.(1)C、N、O 2020-07-25 …
我国是最早使用铁器的国家之一,下列关于铁的知识叙述正确的是()A.钢就是纯铁B.铁在干燥的空气中易生 2020-11-03 …
钢铁的使用是人类文明和进步的重要标志.某钢铁公司用500t含氧化铁64%的赤铁矿石进行炼铁.计算:( 2020-11-08 …
已知ρ铜>ρ铁>ρ铝,等体积的铜、铁、铝球浸没在水中,受到的浮力()A.F铜浮>F铁浮>F铝浮B.F 2020-11-20 …
体积相同的铜、铁、铝三个小球,放入水中静止后如图所示.已知这几种物质密度关系是ρ铜>ρ铁>ρ铝>ρ水 2020-12-04 …
1.下列列举的与电话有关的部件中,装在话筒里的有,装在听筒里面的有.A螺线管B碳粒C用碳精制成的振动 2020-12-22 …