早教吧作业答案频道 -->化学-->
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是.(2)利用制盐后的盐卤提取溴的工艺流程如
题目详情
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是___.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
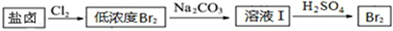
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□___+□___
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
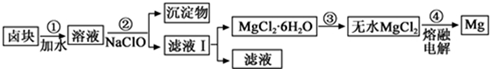
生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是___.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是___.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为___.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO___g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是___.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
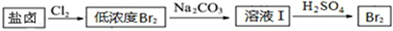
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□___+□___
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是___.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为___.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO___g.
▼优质解答
答案和解析
(1)电解氯化钠溶液在阴极生成氢氧化钠和氢气,阳极生成氯气,其电解反应的离子方程式是2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,
故答案为:3、3、1、5NaBr、3CO2;
(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
故答案为:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl-和H+,反应的离子方程式为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
故答案为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2O⇌Mg(OH)2+2H+,水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;
故答案为:Mg2++2H2O⇌Mg(OH)2+2H+;
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,故答案为:22.35.
| ||
故答案为:2Cl-+2H2O
| ||
(2)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,
故答案为:3、3、1、5NaBr、3CO2;
(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
故答案为:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl-和H+,反应的离子方程式为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
故答案为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2O⇌Mg(OH)2+2H+,水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;
故答案为:Mg2++2H2O⇌Mg(OH)2+2H+;
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,故答案为:22.35.
看了 海水是一个巨大的化学资源宝库...的网友还看了以下:
如图表示基因工程中获取同种目的基因DNA片段的不同方法.有关叙述中正确的是()A.①②③片段均不含 2020-04-08 …
纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产.(1)起初,人们从盐碱地和盐湖 2020-04-11 …
如图表示基因工程中获取水稻某目的基因的不同方法.下列相关叙述中正确的是()A.这三种方法都用到酶, 2020-05-02 …
帮我解决一下这些化学问题1、写一个用酸和碱反应得到一种肥料硝酸钾的方程式和一种铜盐与碱反应生成两种 2020-05-13 …
如图表示细胞膜上乙酰胆碱(一种神经递质)受体基因的克隆技术操作过程,下列相关分析中正确的是()A. 2020-05-13 …
如图表示基因工程中获取水稻某目的基因的不同方法.下列相关叙述中正确的是()A.这三种方法都用到酶, 2020-06-13 …
原子核从核外电子壳层中俘获一个轨道电子的衰变过程称为轨道电子俘获,该过程也称为β衰变.如:2211 2020-06-20 …
在某校,一学科的学习由必修、选修两门课程组成,对某层次学生调查统计知,有且仅有一门课程获得学分概率 2020-07-25 …
请举例铝盐与强碱反应碱不足和碱足量的化学反程式,各一个就行四羟基合铝酸钠与强酸反应酸不足,酸足量的化 2020-11-07 …
下列关于基因工程说法正确的个数是()①获取目的基因是实施基因工程的第一步,也是基因工程的核心;②从基 2020-11-11 …