早教吧作业答案频道 -->化学-->
根据元素周期表中第四周期元素的相关知识,回答下列问题:(1)第四周期元素的基态原子的电子排布中4s轨道上只有一个电子的元素有种;写出Cu+的核外电子排布式.(2)按电子排
题目详情
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有一个电子的元素有___种;写出Cu+的核外电子排布式___.
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元 素有___种,属于d区的元素有___种.
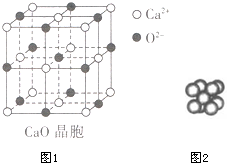
(3)CaO晶胞如图1所示,CaO晶体中Ca2+的配位数为___;CaO的焰色反应为砖红色,许多金属或它们的化合物都可 以发生焰色反应,其原因是___.
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)═2K(l)+3N2(g),下列有关说法正确的是___(填选项字母).
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图2所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂.O2在其催化作用下,可将CN-氧化成CNO-.CN-的电子式为___,CNO-的中心原子的杂化方式为___.
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)]x+(n和x均为正整数)的配 离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol•L-1 NaOH溶液25.00mL,则该配离子的化学式为___.

(1)第四周期元素的基态原子的电子排布中4s轨道上只有一个电子的元素有___种;写出Cu+的核外电子排布式___.
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元 素有___种,属于d区的元素有___种.
(3)CaO晶胞如图1所示,CaO晶体中Ca2+的配位数为___;CaO的焰色反应为砖红色,许多金属或它们的化合物都可 以发生焰色反应,其原因是___.
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)═2K(l)+3N2(g),下列有关说法正确的是___(填选项字母).
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图2所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂.O2在其催化作用下,可将CN-氧化成CNO-.CN-的电子式为___,CNO-的中心原子的杂化方式为___.
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)]x+(n和x均为正整数)的配 离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol•L-1 NaOH溶液25.00mL,则该配离子的化学式为___.
▼优质解答
答案和解析
(1)4s轨道上只有1个电子的元素有K、Cr、Cu三种元素;Cu原子序数为29,核外电子排布式为:1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去了4s轨道的电子,
故答案为:3;1s22s22p63s23p63d10;
(2)s区包括第ⅠA、ⅡA族,第四周期只有K、Ca两种元素,属于d区的元素有ⅢB族~ⅦB族元素、Ⅷ族元素,共8种元素,
故答案为:2;8;
(3)O2-的配位数为6,为1:1型化合物,则Ca2+的配位数也为6,激发态的电子从能量高的轨道跃迁到能量低的轨道,以一定波长光的形式释放能量,
故答案为:6;激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量;
(4)A.离子半径小,晶格能越大,钠离子半径小于钾离子,NaN3的晶格能大于KN3的,故A错误;
B.钾原子位于顶点和体心,每个晶胞含钾原子为1+8×
=2,故B正确;
C.氮原子价电子排布式为2s22p3,2p轨道半充满,较为稳定,第一电离能大于氧原子,故C正确;
D.氮气分子内形成氮氮三键,键能很大,所以其化学性质稳定,并不是因为电负性小,故D错误;
故答案为:BC;
(5)CN-与N2互为等电子体,二者结构相似,CN-中C原子与N原子之间形成3对共用电子对,CN-的电子式为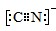 ,CNO-离子与CO2为等电子体,与CO2杂化类型一致,为sp杂化,
,CNO-离子与CO2为等电子体,与CO2杂化类型一致,为sp杂化,
故答案为: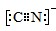 ;sp杂化;
;sp杂化;
(6)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,所以x=
=2,
[CrCln(H2O)6-n]x+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+,
故答案为:[CrCl(H2O)5]2+.
故答案为:3;1s22s22p63s23p63d10;
(2)s区包括第ⅠA、ⅡA族,第四周期只有K、Ca两种元素,属于d区的元素有ⅢB族~ⅦB族元素、Ⅷ族元素,共8种元素,
故答案为:2;8;
(3)O2-的配位数为6,为1:1型化合物,则Ca2+的配位数也为6,激发态的电子从能量高的轨道跃迁到能量低的轨道,以一定波长光的形式释放能量,
故答案为:6;激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量;
(4)A.离子半径小,晶格能越大,钠离子半径小于钾离子,NaN3的晶格能大于KN3的,故A错误;
B.钾原子位于顶点和体心,每个晶胞含钾原子为1+8×
| 1 |
| 8 |
C.氮原子价电子排布式为2s22p3,2p轨道半充满,较为稳定,第一电离能大于氧原子,故C正确;
D.氮气分子内形成氮氮三键,键能很大,所以其化学性质稳定,并不是因为电负性小,故D错误;
故答案为:BC;
(5)CN-与N2互为等电子体,二者结构相似,CN-中C原子与N原子之间形成3对共用电子对,CN-的电子式为
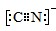 ,CNO-离子与CO2为等电子体,与CO2杂化类型一致,为sp杂化,
,CNO-离子与CO2为等电子体,与CO2杂化类型一致,为sp杂化,故答案为:
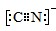 ;sp杂化;
;sp杂化;(6)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,所以x=
| 0.003mol |
| 0.0015mol |
[CrCln(H2O)6-n]x+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+,
故答案为:[CrCl(H2O)5]2+.
看了 根据元素周期表中第四周期元素...的网友还看了以下:
据史载,元代前期,“九儒十丐”,文人纷纷将才情宣泄在戏剧创作中,促进了元杂剧的昌盛;元后期,科举考 2020-07-02 …
如图是钠元素、氟元素在元素周期表中的位置,请完成下列各问:(1)氟元素的原子序数是,属于非金属元素 2020-07-29 …
一种有趣的钟表式元素周期表如图所示,关于时针所对应的元素说法中正确的是A.12:00对应的元素为金 2020-07-29 …
(14分)下图是由EmilZmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种 2020-10-30 …
I.如图是由EmilZmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素 2020-10-30 …
小明的爸爸在银行存入a万元,存期三年,年利率为5%,到期时应得到利息是------元(用代数式表示) 2020-11-05 …
小明的爸爸在银行存入a万元,存期三年,年利率为5%,到期时应得到利息是------元(用代数式表示) 2020-11-05 …
下列关于教材附录长式元素周期表的结构的说法中正确的是()A.元素周期表有七个横行,也就是七个周期B. 2020-12-02 …
目前使用的长式元素周期表中含元素最多的周期是周期,有种元素. 2020-12-02 …
李阿姨家安装了峰谷计量式电表.高峰期间用电每千瓦时0.5元,低谷期间用电每千瓦时0.3元,上个月谷用 2020-12-27 …