早教吧作业答案频道 -->化学-->
亚硝酸氯(ClNO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)⇌2ClNO(g)(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯
题目详情
亚硝酸氯(ClNO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)⇌2ClNO(g)
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)⇌2ClNO(g)K3
则K1,K2,K3之间的关系为K3=___.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+Cl2(g)⇌2ClNO(g)反应的△H和a的关系为△H=___kJ/mol.
(3)300℃时.2NO(g)+Cl2(g)⇌2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
n=___;k=___(注明单位).
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
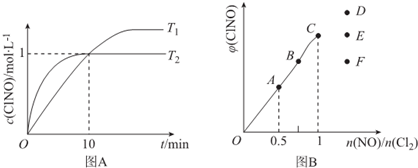
①该反应的△H___0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=___mol/(L•min),
③T2时该反应的平衡常数K=___
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随
=的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是___点,当
=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的___点.
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)⇌2ClNO(g)K3
则K1,K2,K3之间的关系为K3=___.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
(3)300℃时.2NO(g)+Cl2(g)⇌2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),
测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10 -9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①该反应的△H___0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=___mol/(L•min),
③T2时该反应的平衡常数K=___
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随
| n(NO) |
| n(Cl2) |
| n(NO) |
| n(Cl2) |
▼优质解答
答案和解析
(1)已知:①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)⇌2ClNO(g)K3
由盖斯定律可知2②-①=③,焓变为倍数关系,而K为指数关系,则平衡常数K3=
;
故答案为:
;
(2)反应的△H=反应物的总键能-生成物的总键能,则△H=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
故答案为:289-2a;
(3)v正=k•cn(ClNO),则
=
,解得n=2;将n代入①中得k=
L/(mo1•s)=
4.0×10-8L/(mo1•s);
故答案为:2;4.0×10-8L/(mo1•s);
(4)①根据图象可知T1<T2,温度越高,反应速率越大,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
故答案为:<;
②在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),10min时c(ClNO)=1mol/L,则此时c(NO)=1mol/L,v(NO)=
=0.1mol/(L•min);
故答案为:0.1;
③平衡时c(ClNO)=1mol/L,c(NO)=1mol/L,c(Cl2)=0.5mol/L,则反应2NO(g)+Cl2(g)⇌2ClNO(g)的K=
=2;
故答案为:2;
(5)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点;当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大,为D;
故答案为:A;D.
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)⇌2ClNO(g)K3
由盖斯定律可知2②-①=③,焓变为倍数关系,而K为指数关系,则平衡常数K3=
| K12 |
| K2 |
故答案为:
| K12 |
| K2 |
(2)反应的△H=反应物的总键能-生成物的总键能,则△H=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
故答案为:289-2a;
(3)v正=k•cn(ClNO),则
| 1.44×10-8 |
| 3.6×10-9 |
| k•0.62 |
| k•0.32 |
| 3.6×10-9 |
| 0.32 |
4.0×10-8L/(mo1•s);
故答案为:2;4.0×10-8L/(mo1•s);
(4)①根据图象可知T1<T2,温度越高,反应速率越大,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
故答案为:<;
②在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),10min时c(ClNO)=1mol/L,则此时c(NO)=1mol/L,v(NO)=
| 1mol/L |
| 10min |
故答案为:0.1;
③平衡时c(ClNO)=1mol/L,c(NO)=1mol/L,c(Cl2)=0.5mol/L,则反应2NO(g)+Cl2(g)⇌2ClNO(g)的K=
| 12 |
| 12×0.5 |
故答案为:2;
(5)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点;当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大,为D;
故答案为:A;D.
看了 亚硝酸氯(ClNO)是有机合...的网友还看了以下:
顺便给我讲讲各种各样化学式与化合价的题.金属MG在空气中中燃烧可生成MGO和MG3N2,在MG3O 2020-04-27 …
如图为地震波与地球内部构造示意图,读图回答下列问题:(1)在a图中,A表示波,B表示波.(2)在b 2020-05-02 …
(1)在NO3中N显价;(2)KMnO4中K显价;(3)已知P显+5价,它的氧化物的化学式是;(4 2020-05-13 …
数学集合中,N,N*,Z,Q,R, 2020-06-08 …
集合中N星 2020-06-12 …
组合函数C(n,k)在给定的n个元素的集合中求不同的(无序的)k个元素的子集的个数.该函数可以用以 2020-07-29 …
集合中N和N+有区别么,0既不是正数也不是负数对吗 2020-07-30 …
下列有关生物体内化合物中N的存在部位的描述,错误的是()A.DNA分子中的N主要存在于胸腺嘧啶(T) 2020-10-30 …
1.以知集合A=『2n/n∈Z』,B=『4n+2,4n-2/n∈Z』,则集合A、B之间的关系是什么? 2020-12-07 …
在集合中N与Q的关系 2020-12-25 …