早教吧作业答案频道 -->化学-->
研究氮的固定具有重要意义.(1)雷雨天气中发生自然固氮后,氮元素转化为而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:2N2(g)+6H2O(l)=4NH3
题目详情
研究氮的固定具有重要意义.
(1)雷雨天气中发生自然固氮后,氮元素转化为___而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ•mol-1 K1②
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1 K2③
则△H=___;K=___(用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
下列能说明反应①达到平衡状态的是___(填字母).
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___;第四组反应中以NH3表示的反应速率是___,与前三组相比,NH3生成量最小的原因可能是___.
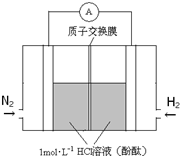
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如图:则开始阶段正极反应式为___;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH=7时,溶液中NH3•H2O的浓度为___( Kb=2×10-5mol•L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为___.

(1)雷雨天气中发生自然固氮后,氮元素转化为___而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ•mol-1 K1②
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1 K2③
则△H=___;K=___(用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___;第四组反应中以NH3表示的反应速率是___,与前三组相比,NH3生成量最小的原因可能是___.
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如图:则开始阶段正极反应式为___;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH=7时,溶液中NH3•H2O的浓度为___( Kb=2×10-5mol•L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为___.
▼优质解答
答案和解析
(1)雷雨天气中发生自然固氮后,N2→NO→NO2→NO3-,氮元素转化为硝酸盐而存在土壤中,根据盖斯定律①=②×2-③×3,△H=-92.4kJ•mol-1×2+3×571.6kJ•mol-1=+1530kJ•mol-1,K=
;故答案为:硝酸盐;+1530kJ•mol-1;
;
(2)在反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,
a.NH3和O2的物质的量之比为4:3,反应不一定平衡;
b.反应混合物中各组份的质量分数不变,反应达到平衡;
c.单位时间内每消耗1molN2的同时生成2molNH3,都向正反应方向移动,反应不一定平衡;
d.容器内气体密度逐渐增大,当不变时,反应达到平衡;
若第三组反应3h后已达平衡,反应的N2的为
×6.0×10-6mol=3.0×10-6mol,第三组N2的转化率为
×100%=3×10-4%;
3小时内根据NH3浓度的变化量,得v(NH3)=
=3.33×10-7mol/(L•h),第四组温度最高但达平衡时,氨气的物质的量最小,可能是催化剂在80℃活性减小,反应速率反而减慢,
故答案为:bd;3×10-4%;3.33×10-7mol/(L•h);催化剂在80℃活性减小,反应速率反而减慢;
(3)开始阶段N2在正极发生还原反应,N的化合价降低为-3价,结合H+生成NH4+,正极反应式为N2+8H++6e-=2NH4+;当电池中阴极区溶液pH=7时,c(OH-)=1×10-7mol/L,根据电荷守恒,可知c(NH4+)=c(Cl-)=1mol/L,溶液中NH3•H2O,Kb=
=
=2×10-5mol•L-1;c(NH3•H2O)=5×10-3mol•L-1;当电池中阴极区呈红色时,溶液显碱性,则溶液中的离子浓度大小顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:N2+8H++6e-=2NH4+;5×10-3mol•L-1;c(NH4+)>c(Cl-)>c(OH-)>c(H+).
| ||
|
| ||
|
(2)在反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,
a.NH3和O2的物质的量之比为4:3,反应不一定平衡;
b.反应混合物中各组份的质量分数不变,反应达到平衡;
c.单位时间内每消耗1molN2的同时生成2molNH3,都向正反应方向移动,反应不一定平衡;
d.容器内气体密度逐渐增大,当不变时,反应达到平衡;
若第三组反应3h后已达平衡,反应的N2的为
| 1 |
| 2 |
| 3.0×10-6mol |
| 1mol |
3小时内根据NH3浓度的变化量,得v(NH3)=
| 2×10-6mol |
| 2L•3h |
故答案为:bd;3×10-4%;3.33×10-7mol/(L•h);催化剂在80℃活性减小,反应速率反而减慢;
(3)开始阶段N2在正极发生还原反应,N的化合价降低为-3价,结合H+生成NH4+,正极反应式为N2+8H++6e-=2NH4+;当电池中阴极区溶液pH=7时,c(OH-)=1×10-7mol/L,根据电荷守恒,可知c(NH4+)=c(Cl-)=1mol/L,溶液中NH3•H2O,Kb=
c(N
| ||
| c(NH3•H2O) |
| 1mol/L×1×10-7mol/L |
| c(NH3•H2O) |
故答案为:N2+8H++6e-=2NH4+;5×10-3mol•L-1;c(NH4+)>c(Cl-)>c(OH-)>c(H+).
看了 研究氮的固定具有重要意义.(...的网友还看了以下:
某实验小组利用如图1所示装置,探究木块在木板上滑动至停止的过程中,摩擦力做的功与木块滑上木板时初速 2020-06-16 …
某同学要探究弹力和弹簧伸长的关系,并测弹簧的劲度系数k.做法是先将待测弹簧的一端固定在铁架台上,然 2020-06-23 …
某同学和你一起探究弹簧的弹力和弹簧伸长量的关系,并测弹簧的劲度系数k.做法是先将待测弹簧的上端固定 2020-06-23 …
某一学习小组在探究弹力和弹簧伸长量的关系.(1)将弹簧悬挂在铁架台上,将刻度尺固定在弹簧一侧,弹簧 2020-07-13 …
某同学探究弹力与弹簧伸长量的关系.(1)将弹簧悬挂在铁架台上,将刻度尺固定在弹簧一侧,弹簧轴线和刻 2020-07-21 …
为了研究“电荷间相互作用的规律”及“电荷间相互作用力的大小与哪些因素有关”,小聪将一个带正电的物体 2020-07-24 …
在研究液体发生凝固的物态变化时,小明提出一个问题:液体凝固过程中是吸热还是放热?为此,他做了一次探究 2020-11-05 …
在自主学习探究过程中某同学利用带拉环的吸盘,固定在墙上的平面镜,水,刻度尺在自在自主学习探究过程中 2020-12-24 …
在自主学习探究过程中某同学利用带拉环的吸盘,固定在在墙上的平面镜,水,刻度尺来测量大气压强的大小,在 2020-12-24 …
以下是一次课堂“探究合力F与分力F1、F2有什么关系”的实验过程:(1)如图所示把方木板固定在黑板上 2021-01-15 …