早教吧作业答案频道 -->化学-->
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H已知几种化学键的键能如表:化学键N-H
题目详情
氨催化氧化是硝酸工业的基础,按要求回答下列问题:
(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
①由此计算得出△H=___ (用上表中字母表示)kJ•mol-1.
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为___;该反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___.
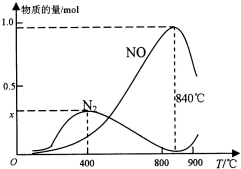
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2⇌N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=___.
②NH3生成NO和N2的反应分别属于___、___(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是___(只答一条即可).

(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为___;该反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2⇌N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=___.
②NH3生成NO和N2的反应分别属于___、___(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是___(只答一条即可).
▼优质解答
答案和解析
(1)①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),反应的焓变△H=反应物键能总和-生成物的键能总和=12x+5n-4y-12m,故答案为:12x+5n-4y-12m;②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器...
看了氨催化氧化是硝酸工业的基础,按...的网友还看了以下:
有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键 2020-04-07 …
某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,核磁共振氢 2020-06-26 …
H2O2(g)的生成热为133kJ•mol-1,O-H键能为463kJ•mol-1,而H2和O2的 2020-07-17 …
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mo 2020-07-19 …
已知H-H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2( 2020-07-19 …
CH3CH2OH:氧化断同碳原子上的C-H和O-H键,形成C=O键.请问:C=O键是怎样形成的? 2020-07-24 …
用现代化学方法测定某有机物结构:红外光谱图表征显示有C-H键、O-H键、C-O键的振动吸收;核磁共振 2020-11-25 …
用现代化学方法测定某有机物结构:质谱图表明其相对分子质量为60;红外光谱图表征到C-H键、O-H键、 2020-11-29 …
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下 2020-12-25 …
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下 2020-12-31 …