早教吧作业答案频道 -->化学-->
某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵.已知盐的热分解温度:NH4HCO336℃;NaHCO3270℃;NH4Cl340℃;Na2CO3>850℃(1)粗盐中含有Ca2+、Mg2+、SO42-等
题目详情
某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵.
已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃
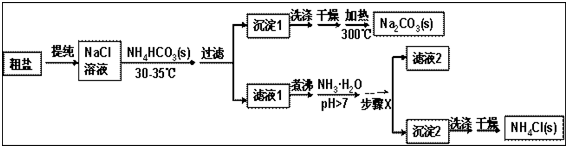
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3,其加入的顺序合理的是___
A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是___
(2)如何判断粗盐中SO42-是否已除尽?___;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是___;
(4)写出沉淀1受热分解的化学方程式___;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是___;
步骤X包括的操作有___;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为___.
已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3,其加入的顺序合理的是___
A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是___
(2)如何判断粗盐中SO42-是否已除尽?___;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是___;
(4)写出沉淀1受热分解的化学方程式___;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是___;
步骤X包括的操作有___;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为___.
▼优质解答
答案和解析
根据题中流程可知,粗盐水提纯后得氯化钠溶液,经蒸发浓缩后,温度控制在30℃~35℃,防止碳酸氢按分解,加入碳酸氢铵,生成沉淀1为碳酸氢钠,滤液1主要为氯化铵,氯化铵溶液中加入氨水,可抑制铵根离子的水解,经过蒸发浓缩、冷却结晶、过滤可得沉淀2为氯化铵固体,经洗涤、干燥得纯净的氯化铵,滤液2中含有少量的氯化铵和碳酸氢钠,
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3,根据前面加入的物质是过量的,在后面加入的物质在除去溶液中原来的杂质外还要将前面加入的试剂杂质除去,所以加入的顺序为NaOH、BaCl2、Na2CO3、HCl,故选B;过滤中用到玻璃棒的作用是引流,
故答案为:B;引流;
(2)样品中加入适量的氯化钡溶液可判断粗盐中SO42-是否已除尽,具体操作为取少量除杂后的样品于试管中,滴加适量氯化钡溶液,若无白色沉淀产生,则含SO42-已除尽,
故答案为:取少量除杂后的样品于试管中,滴加适量氯化钡溶液,若无白色沉淀产生,则含SO42-已除尽;
(3)蒸发浓缩时溶液要加热,而NH4HCO3在36℃开始分解,所以在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是可避免NH4HCO3的分解,
故答案为:可避免NH4HCO3的分解;
(4)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应方程式为2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(5)氨水能抑制铵根离子的水解,同时能使NaHCO3转化为Na2CO3,并补充煮沸时损失的NH3,从氯化铵溶液得到氯化铵固体可以通过蒸发浓缩,冷却结晶,过滤的方法,
故答案为:抑制NH4+水解、使NaHCO3转化为Na2CO3、补充煮沸时损失的NH3;蒸发浓缩、冷却结晶、过滤;
(6)根据题意,滴定用去的氢氧化钠的物质的量为0.025L×0.1mol/L=0.0025mol,所以盐酸的物质的量为0.0025mol,根据方程式4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O,可知1.5g该样品中氯化铵的质量为0.0025mol×
×53.5g/mol=1.3375g,所以样品中氯化铵的质量分数为
×100%=89.2%,
故答案为:89.2%.
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3,根据前面加入的物质是过量的,在后面加入的物质在除去溶液中原来的杂质外还要将前面加入的试剂杂质除去,所以加入的顺序为NaOH、BaCl2、Na2CO3、HCl,故选B;过滤中用到玻璃棒的作用是引流,
故答案为:B;引流;
(2)样品中加入适量的氯化钡溶液可判断粗盐中SO42-是否已除尽,具体操作为取少量除杂后的样品于试管中,滴加适量氯化钡溶液,若无白色沉淀产生,则含SO42-已除尽,
故答案为:取少量除杂后的样品于试管中,滴加适量氯化钡溶液,若无白色沉淀产生,则含SO42-已除尽;
(3)蒸发浓缩时溶液要加热,而NH4HCO3在36℃开始分解,所以在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是可避免NH4HCO3的分解,
故答案为:可避免NH4HCO3的分解;
(4)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应方程式为2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(5)氨水能抑制铵根离子的水解,同时能使NaHCO3转化为Na2CO3,并补充煮沸时损失的NH3,从氯化铵溶液得到氯化铵固体可以通过蒸发浓缩,冷却结晶,过滤的方法,
故答案为:抑制NH4+水解、使NaHCO3转化为Na2CO3、补充煮沸时损失的NH3;蒸发浓缩、冷却结晶、过滤;
(6)根据题意,滴定用去的氢氧化钠的物质的量为0.025L×0.1mol/L=0.0025mol,所以盐酸的物质的量为0.0025mol,根据方程式4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O,可知1.5g该样品中氯化铵的质量为0.0025mol×
| 100 |
| 10 |
| 1.3375g |
| 1.5g |
故答案为:89.2%.
看了某研究小组以粗盐和碳酸氢铵(N...的网友还看了以下:
第一次电动机不转电压0.4V电流0.2A第二次转电压2V电流0.3A求效率某同学对录音机中的小电动 2020-05-17 …
下图示意某区域1月份0℃气温等温线分布,读图完成以下问题。1.导致图中0℃等温线弯曲的主要因素是A 2020-07-09 …
如图为“我国东南沿海某流域等流时线图(等流时线是流域内地表径流汇流到河口时间相等的各点连线)”。读 2020-07-21 …
图为世界某区域1月份0℃等温线示意图,读图回答下列问题。9.图中1月份0℃等温线在B处发生较大弯曲的 2020-11-02 …
下图为我国东南沿海某流域等流时线图(等流时线是流城内地表径流汇流到河口时间相等的各点连线),读图回答 2020-12-08 …
下图是某流域等流时线图(等流时线是流域内的降雨汇流到河口所用时间相等的点的连线。此图以小时为单位)及 2020-12-08 …
下图为我国东南沿海某流域等流时线图(等流时线是流域内地表径流汇流到河口时间相等的各点连线),读图回答 2020-12-08 …
该图是某流域等流时线图(等流时线是流域内的降雨汇流到河口所用时间相等的点的连线。此图以小时为单位)及 2020-12-08 …
该图是某流域等流时线图(等流时线是流域内的降雨汇流到河口所用时间相等的点的连线。此图以小时为单位)及 2020-12-08 …
假设某次闪电产生的电压可等效为2.5×107V,电流可等效为2×105A,历时1×10-3s,问:( 2021-01-19 …