早教吧作业答案频道 -->化学-->
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2→加热催化剂2SO3,经一段时间后,
题目详情
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2→加热催化剂2SO3,经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L•s)
①则这段时间为___s.
②该反应达到平衡状态的标志是___.
A.容器内硫元素物质的量分数不变 B.混合物的平均相对分子质量不变
C.n(SO2):n(O2):n(SO3)=2:1:2 D.各组分的体积分数不变
(2)利用烧渣制绿矾的过程如下
操作I的名称___,溶液A的溶质___,固体B是___.
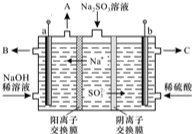
(3)某科研机构用NaOH溶液吸收废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示,(电极材料为石墨)
①图中b极要连接电源的___极(填“正”或“负”)
②SO32-放电的电极反应式为___.
③若用甲烷-空气燃料电池作电源,处理标准状况下40m3的废气(其中SO2的体积分致为0.2 ),理论上需要消耗标准状况下甲烷___m3.

(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2→加热催化剂2SO3,经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L•s)
①则这段时间为___s.
②该反应达到平衡状态的标志是___.
A.容器内硫元素物质的量分数不变 B.混合物的平均相对分子质量不变
C.n(SO2):n(O2):n(SO3)=2:1:2 D.各组分的体积分数不变
(2)利用烧渣制绿矾的过程如下

操作I的名称___,溶液A的溶质___,固体B是___.
(3)某科研机构用NaOH溶液吸收废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示,(电极材料为石墨)
①图中b极要连接电源的___极(填“正”或“负”)
②SO32-放电的电极反应式为___.
③若用甲烷-空气燃料电池作电源,处理标准状况下40m3的废气(其中SO2的体积分致为0.2 ),理论上需要消耗标准状况下甲烷___m3.
▼优质解答
答案和解析
(1)①用O2表示的反应速率为0.04mol/(L•s),反应速率之比等于化学方程式计量数之比,
则v(SO3)=2v(O2)=2×0.04mol/(L•s)=0.08mol/(L•s),
故反应时间=
=5s,
故答案为:5;
②反应是气体体积减小的放热反应,
A.容器内硫元素物质的量分数始终不变,不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量不变,气体物质的量减小,当混合物的平均相对分子质量不变,说明反应达到平衡状态,故B正确;
C.n(SO2):n(O2):n(SO3)=2:1:2 是化学反应之比,不能说明反应达到化学平衡状态,故C错误;
D.各组分的体积分数不变式平衡标志,故D正确;
故答案为:BD;
(2)烧渣ag主要成分是Fe2O3及少量FeS、SiO2,加入溶液A为稀硫酸,溶解过滤得到溶液X为硫酸铁和硫酸亚铁,加入固体B为金属铁,铁和铁离子反应生成亚铁离子,过滤得到滤液为硫酸亚铁溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸亚铁晶体,
操作I是分离溶液和固体的操作,名称为:过滤,溶液A的溶质为稀硫酸,固体B为Fe,
故答案为:过滤;硫酸; Fe;
(3)①依据图中离子移动方向判断,a为阴极,与之连接的电池电极为负极,b为阳极,与之连接的电池电极为正极,
故答案为:正;
②SO32-放电失电子生成硫酸根离子,电极反应为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+;
③甲烷作燃料在负极失电子被氧化成二氧化碳,二氧化碳与电解质氢氧化钠溶液发生反应,生成二氧化碳和水,电极反应为:CH4-8e-+10OH-═CO32-+7H2O,氧气在正极得电子发生还原反应:O2+4e-+2H2O═4OH-,
处理标准状况下40m3的废气(其中SO2的体积分数为0.2 ),二氧化硫物质的量=
,电解中阳极电极反应为:SO32--2e-+H2O=SO42-+2H+,
电子转移为n=
×2=714.28mol,
CH4~8e-~4SO32-~8e-
理论上需要消耗标准状况下甲烷物质的量n(CH4)=
=89.29mol,
理论上需要消耗标准状况下甲烷体积=89.29mol×22.4L/mol=2000L=2m3,
故答案为:2.
则v(SO3)=2v(O2)=2×0.04mol/(L•s)=0.08mol/(L•s),
故反应时间=
| 0.4mol/L |
| 0.08mol/(L•s) |
故答案为:5;
②反应是气体体积减小的放热反应,
A.容器内硫元素物质的量分数始终不变,不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量不变,气体物质的量减小,当混合物的平均相对分子质量不变,说明反应达到平衡状态,故B正确;
C.n(SO2):n(O2):n(SO3)=2:1:2 是化学反应之比,不能说明反应达到化学平衡状态,故C错误;
D.各组分的体积分数不变式平衡标志,故D正确;
故答案为:BD;
(2)烧渣ag主要成分是Fe2O3及少量FeS、SiO2,加入溶液A为稀硫酸,溶解过滤得到溶液X为硫酸铁和硫酸亚铁,加入固体B为金属铁,铁和铁离子反应生成亚铁离子,过滤得到滤液为硫酸亚铁溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸亚铁晶体,
操作I是分离溶液和固体的操作,名称为:过滤,溶液A的溶质为稀硫酸,固体B为Fe,
故答案为:过滤;硫酸; Fe;
(3)①依据图中离子移动方向判断,a为阴极,与之连接的电池电极为负极,b为阳极,与之连接的电池电极为正极,
故答案为:正;
②SO32-放电失电子生成硫酸根离子,电极反应为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+;
③甲烷作燃料在负极失电子被氧化成二氧化碳,二氧化碳与电解质氢氧化钠溶液发生反应,生成二氧化碳和水,电极反应为:CH4-8e-+10OH-═CO32-+7H2O,氧气在正极得电子发生还原反应:O2+4e-+2H2O═4OH-,
处理标准状况下40m3的废气(其中SO2的体积分数为0.2 ),二氧化硫物质的量=
| 40m3×0.2×1000L/m3 |
| 22.4L/mol |
电子转移为n=
| 40m3×0.2×1000L/m3 |
| 22.4L/mol |
CH4~8e-~4SO32-~8e-
理论上需要消耗标准状况下甲烷物质的量n(CH4)=
| 714.28mol |
| 8 |
理论上需要消耗标准状况下甲烷体积=89.29mol×22.4L/mol=2000L=2m3,
故答案为:2.
看了硫酸厂用煅烧黄铁矿(FeS2)...的网友还看了以下:
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学 2020-05-13 …
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学 2020-06-15 …
1..将混有少量氧化铜的铁粉投入稀硫酸,反应停止后过滤,取少量滤渣,加入盐酸,仍有气泡产生,则滤渣 2020-07-07 …
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸 2020-11-02 …
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸 2020-11-26 …
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和 2020-12-07 …
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3)和回收(N 2020-12-07 …
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和 2020-12-07 …
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,A 2020-12-20 …
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,A 2020-12-20 …