早教吧作业答案频道 -->化学-->
如图是实验室用稀硫酸和亚硫酸钠制SO2并验证SO2某些性质的装置图,试回答:(1)⑥中发生的化学反应方程式为.(2)①中实验现象为.(3)②中品红溶液,证明SO2有性.(4)③
题目详情
如图是实验室用稀硫酸和亚硫酸钠制SO2并验证SO2某些性质的装置图,试回答:
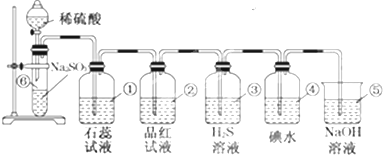
(1)⑥中发生的化学反应方程式为___.
(2)①中实验现象为___.
(3)②中品红溶液___,证明SO2有___性.
(4)③中现象是___,证明SO2有___性.
(5)④中现象是___,证明SO2有___性.
(6)⑤的作用是___,反应的化学方程式为___.

(1)⑥中发生的化学反应方程式为___.
(2)①中实验现象为___.
(3)②中品红溶液___,证明SO2有___性.
(4)③中现象是___,证明SO2有___性.
(5)④中现象是___,证明SO2有___性.
(6)⑤的作用是___,反应的化学方程式为___.
▼优质解答
答案和解析
(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,
故答案为:溶液变为红色;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,
故答案为:褪色;漂白;
(4)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,
故答案为:淡黄色沉淀;氧化;
(5)④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,
故答案为:氯水褪色;还原;
(6)⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,化学方程式为SO2+2NaOH═Na2SO3+H2O,
故答案为:吸收多余的二氧化硫,防止污染空气;SO2+2NaOH═Na2SO3+H2O.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,
故答案为:溶液变为红色;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,
故答案为:褪色;漂白;
(4)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,
故答案为:淡黄色沉淀;氧化;
(5)④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,
故答案为:氯水褪色;还原;
(6)⑤为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,化学方程式为SO2+2NaOH═Na2SO3+H2O,
故答案为:吸收多余的二氧化硫,防止污染空气;SO2+2NaOH═Na2SO3+H2O.
看了如图是实验室用稀硫酸和亚硫酸钠...的网友还看了以下:
(1)碳酸钠(Na2CO3)的相对分子质量为.(2)分子个数相同的H2O与CO2之间氧元素的质量比 2020-05-12 …
两金属杆ab和cd长度,电阻均相同,质量分别为M和m,已知M>m.两根质量和电阻均可忽略的不可伸长 2020-06-27 …
小金在实验室利用光具座研究凸透镜成像的规律.(1)当小金将三个元件移动到图示位置时,光品上出现了清 2020-07-01 …
2012年7月,海南省海口市正式开通网络问政平台。网络问政将纳入绩效考评范围,并根据回复率、回复时限 2020-11-06 …
佛并不是指某人,人是本质所暂时依住的现象,见到不生不灭的本质,并能回归的人,才叫佛,本质即为佛,本质 2020-11-06 …
如图所示,两辆质量均为M的小车A和B置于光滑的水平面上,有一质量为m的人静止站在A车上,两车静止.若 2020-11-25 …
光滑水平面上有一质量为M的小车,车上左端放一质量为m的物块(可视为质点),一起以初速v0向右运动,然 2020-12-09 …
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s 2020-12-18 …
如图所示,长度均为l、电阻均为R的两导体杆ab、cd,通过两条足够长的不可伸缩的轻质柔软导线连接起来 2020-12-27 …
两金属杆ab和cd长均为l,电阻均为R,质量分别为M和m,M>m.用两根质量和电阻均可忽略的不可伸长 2020-12-28 …