早教吧作业答案频道 -->化学-->
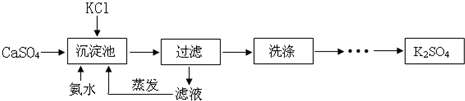
以硫酸钙晶体(石膏的主要成分)与氯化钾为原料制备硫酸钾的流程如图:已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)温度(℃)0102630水溶液7.319.28
题目详情
以硫酸钙晶体(石膏的主要成分)与氯化钾为原料制备硫酸钾的流程如图:
已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
(1)氨水显___(填“酸性”、“碱性”或“中性”),向水中连续通氨气达两个小时可得高浓度氨水,氨气不断溶解使溶液pH___(填“增大”、“减小”或“不变”).上表中“非常压”指需增大气压才能形成30℃的氨(35%)溶液,常压下不能形成30℃的氨(35%)溶液的原因是___.
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是___,沉淀池温度适宜保持
___(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为___;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为___.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、___,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为___.
(5)检验沉淀是否洗净的试剂是___(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液
(6)烟气脱硫能有效减少二氧化硫的排放,能将其转化为石膏(CaSO4•2H2O)等产品,实现“变废为宝”.二氧化硫的排放会导致的环境问题是___,可用___溶液检验烟气中二氧化硫.
(7)某电厂用煤200吨(含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,烟气脱硫中有96%的硫转化为石膏(CaSO4•2H2O),则可生产石膏多少吨?

已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是___,沉淀池温度适宜保持
___(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为___;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为___.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、___,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为___.
(5)检验沉淀是否洗净的试剂是___(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液
(6)烟气脱硫能有效减少二氧化硫的排放,能将其转化为石膏(CaSO4•2H2O)等产品,实现“变废为宝”.二氧化硫的排放会导致的环境问题是___,可用___溶液检验烟气中二氧化硫.
(7)某电厂用煤200吨(含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,烟气脱硫中有96%的硫转化为石膏(CaSO4•2H2O),则可生产石膏多少吨?
▼优质解答
答案和解析
(1)氨水呈碱性,向水中连续通氨气达两个小时可得高浓度氨水,氨气不断溶解则碱性增强,故会使溶液pH增大;
常压30℃时氨气在水中达到饱和时浓度小于35%,故常压下不能形成30℃的氨(35%)溶液.
(2)根据表格提供的数据可以看出,氨水浓度越大,硫酸钾溶解度越小,故沉淀池中氨水浓度常常控制在25%至40%;沉淀池温度适宜保持在低温;
(3)滤液经蒸发后产生可以循环使用的气体是氨气,其化学式为NH3;根据反应的化学方程式可以看出:
CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑
溶质硝酸和溶剂水的微粒个数比为:
2HNO3--5H2O
126 90
故硝酸和水的质量比为:126:90=7:5;
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,稀释浓硫酸时用到玻璃棒的主要作用为 使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)沉淀若是洗涤干净,则不含有氢氧化钙,氢氧化钙呈碱性,能使酚酞变红,能与碳酸钠反应产生沉淀,不能与氯化钡反应,故检验沉淀是否洗净的试剂是AB;
(6)二氧化硫排放到空气中会造成空气污染,随雨水降落会形成酸雨;二氧化硫能使高锰酸钾溶液褪色,可以用高锰酸钾溶液检验二氧化硫;
(7)转化生成石膏的硫元素的质量为:200t×2.5%×96%=4.8t
设生产石膏的质量为x,根据硫元素质量守恒,可以得到:
S------CaSO4•2H2O
32 172
4.8t x
=
x=25.8t
故答案为:(1)碱性,增大,常压30℃时氨气在水中达到饱和时浓度小于35%.
(2)氨水浓度越大,硫酸钾溶解度越小,低温.
(3)NH3,7:5;
(4)漏斗;使溶解产生的热量及时散发,防止局部过热而引起液体飞溅;
(5)AB;
(6)形成酸雨;高锰酸钾;
(7)生产石膏25.8t.
常压30℃时氨气在水中达到饱和时浓度小于35%,故常压下不能形成30℃的氨(35%)溶液.
(2)根据表格提供的数据可以看出,氨水浓度越大,硫酸钾溶解度越小,故沉淀池中氨水浓度常常控制在25%至40%;沉淀池温度适宜保持在低温;
(3)滤液经蒸发后产生可以循环使用的气体是氨气,其化学式为NH3;根据反应的化学方程式可以看出:
CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑
溶质硝酸和溶剂水的微粒个数比为:
2HNO3--5H2O
126 90
故硝酸和水的质量比为:126:90=7:5;
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,稀释浓硫酸时用到玻璃棒的主要作用为 使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)沉淀若是洗涤干净,则不含有氢氧化钙,氢氧化钙呈碱性,能使酚酞变红,能与碳酸钠反应产生沉淀,不能与氯化钡反应,故检验沉淀是否洗净的试剂是AB;
(6)二氧化硫排放到空气中会造成空气污染,随雨水降落会形成酸雨;二氧化硫能使高锰酸钾溶液褪色,可以用高锰酸钾溶液检验二氧化硫;
(7)转化生成石膏的硫元素的质量为:200t×2.5%×96%=4.8t
设生产石膏的质量为x,根据硫元素质量守恒,可以得到:
S------CaSO4•2H2O
32 172
4.8t x
| 32 |
| 172 |
| 4.8t |
| x |
x=25.8t
故答案为:(1)碱性,增大,常压30℃时氨气在水中达到饱和时浓度小于35%.
(2)氨水浓度越大,硫酸钾溶解度越小,低温.
(3)NH3,7:5;
(4)漏斗;使溶解产生的热量及时散发,防止局部过热而引起液体飞溅;
(5)AB;
(6)形成酸雨;高锰酸钾;
(7)生产石膏25.8t.
看了以硫酸钙晶体(石膏的主要成分)...的网友还看了以下:
某同学对生铁的组成进行研究.称取生铁样品40g,把500g稀硫酸分5次加入样品中,测得实验数据见下 2020-05-14 …
硫酸的摩尔质量是多少g/mol,4g纯硫酸的物质的量是多少mol,其中氢元素质量是多少g,硫元素质 2020-05-16 …
为什么发令枪里的主要成分是磷啊枪的主要成分不是火药吗?火药里不是有硫磺吗?为什么发令枪枪响后有的白 2020-07-02 …
来个人,化学平衡晕死了,我写的对不M(G)+N(G)=P(G)+Q(G)压强一定,不平衡M(G)+ 2020-07-04 …
质量分数不同的硫酸溶液其密度不相同.质量分数:10%20%30%40%50%60%70%80%90 2020-07-18 …
化学求解:为什么一氧化氮不与浓硫酸反应(坚持说能反应的请绕道)问题1:老师说一氧化氮以氧化性为主. 2020-07-28 …
(10云南楚雄28)(3分)请从下列物质中选择适当的试剂,设计不同的方法对锌、铁、铜三种金属的活动性 2021-01-02 …
PH等于3的废水水中含有多少g硫酸,PH等于2的废水水中含有多少g硫酸,PH等于1的废水水中含有多少 2021-01-13 …
有一包黑色粉末,主要成分是氧化铜.2g该黑色粉末与l9.6g10%的稀硫酸恰好完全反应,发生反应的化 2021-01-21 …
硫酸的化学式是H2SO4,针对化学式尝试下面计算.(1)196g硫酸中含有多少gH元素?(2)多少g 2021-02-18 …