早教吧作业答案频道 -->化学-->
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:.(2)25℃,在0.10mol
题目详情
研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为___.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:___.
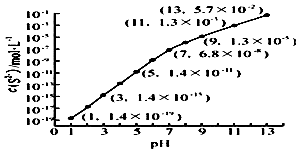
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=___mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=___时,Mn2+开始沉淀.1已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为___.

(1)①硫离子的结构示意图为___.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:___.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=___mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为___.
▼优质解答
答案和解析
(1)①S是16号元素.S原子获得2个电子变为S2-,硫离子的结构示意图为: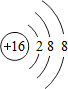 ,故答案为:
,故答案为: ;
;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O;
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=
=
=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5;
(3)电离平衡常数比较可知,HSO3->H2CO3 ,足量NaHSO3溶液与NaHCO3溶液反应生成亚硫酸钠、二氧化碳和水,反应的离子方程式为:2HSO3-+CO32-=2SO32-+CO2↑+H2O,
故答案为:2HSO3-+CO32-=2SO32-+CO2↑+H2O.
 ,故答案为:
,故答案为: ;
;②加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=
| Ksp(MnS) |
| c(Mn2+) |
| 2.8×10-13 |
| 0.020 |
故答案为:5;
(3)电离平衡常数比较可知,HSO3->H2CO3 ,足量NaHSO3溶液与NaHCO3溶液反应生成亚硫酸钠、二氧化碳和水,反应的离子方程式为:2HSO3-+CO32-=2SO32-+CO2↑+H2O,
故答案为:2HSO3-+CO32-=2SO32-+CO2↑+H2O.
看了研究硫元素及其化合物的性质具有...的网友还看了以下:
这个世界的物质种类是无限的么?我认为的物质种类是从化学上纯净物性质分的求助好心人啊 2020-03-30 …
已知丙酮(CH3COCH3)键线式可表示为,则键线式为的物质的分子式为. 2020-05-14 …
如图所示,匀强磁场的磁感应强度方向垂直于纸面向里,大小B=B0-kt,k为正常数.用一根横截面积为 2020-05-17 …
下列选项中,属于法律行为的实质有效要件的有( )。 A.行为人具有相应的民事行为能力B 2020-05-17 …
从行为的性质上看,限制竞争行为是一种( )。 A. 反竞争行为 B. 技术性竞争行为 C. 不正当竞 2020-05-19 …
旅游法律行为的实质要件中,行为人要具有__________ 能力和民事行为能力。 2020-05-20 …
根据行为的性质及其后果,人类行为的类型包括()。A.利他主义行为B.反社会行为C.攻击性行为D.助人 2020-06-04 …
不依法设置会计账簿的,由县级以上人民政府财政部门根据违法行为的性质、情节及危害不依法设置会计账簿的 2020-07-01 …
16、一质量为的匀质细杆AB,A端靠在光滑的竖直墙壁上,B端置于粗糙水平地面上而静止.杆身与竖直方 2020-07-01 …
如图所示,倔强系数为的轻质弹簧两端分别与质量为、的物块1、2拴接,倔强系数为的轻质弹簧上端与物块2 2020-07-11 …