(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+) c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O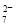 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O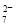 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
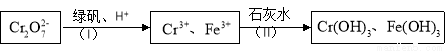
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为 。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
分 析:
(1)生活中明矾常作净水剂,是因为明矾溶于水生成的 Al3+ 发生水解生成可Al(OH)3胶体能吸附水中的杂质,离子方程式为:Al3+ + 3H2O Al(OH)3 + 3H+ 。(2)0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5,说明MOH是弱碱,电离方程式为:MOHM+ + OH-。(3)c(H2A)>c(A2-)说明HA—的水解程度大于电离程度,HA—水解溶液显碱性,则c(H+)<c(OH-)。(4)①Cr2O72-有强氧化性,Fe2+有还原性,发生氧化还原反应,离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O。②Ksp[Cr(OH) 3]=c(Cr3+)×c3(OH-)=3.0×10-6×c3(OH-)=6.0×10-31,得c3(OH-)=2.0×10-25,Ksp[Fe(OH)3]= c(Fe3+) ×c3(OH-)=4.0×10-38,c(Fe3+) ×2.0×10-25=4.0×10-38,c(Fe3+)= 2×10-13 mol·L-1
考点:
盐类的水解及其应用、溶度积的计算、离子方程式的书写。
大师的学生文中的句子揭示的意义是什么?看似紧锣密鼓的工作挑战,永无歇止难度渐升的环境压力,不也就在 2020-04-26 …
如果买a个足球,b个篮球,写出下列式子表示的实际意义.1,a—b表示?2,78a表示?3,94b+ 2020-07-10 …
如果买a个足球、b个蓝球,写出下列式子表示的实际意义."a一b"表示()"78a"表示() 2020-07-10 …
你同时掷两个普通的骰子(正方体6个面上分别标有数字1、2、3、4、5、6),一个是红的,一个是蓝的 2020-07-10 …
“同位素示踪法”可帮助人们认识化学反应的机理.下列用“示踪原子”标示的化学方程式或离子方程式正确的 2020-07-19 …
在一张卡片上写有一个汉字,将卡片垂直于水平镜面放置在镜子前方时,镜子显示的像如图所示,则卡片上的汉 2020-08-02 …
(2011•巢湖i模)“同位素示踪法”可帮助大们认识化学反应的机理.下列用“示踪原子”标示的化学方程 2020-11-12 …
在云室中,为什么α粒子显示的径迹直而粗、β粒子显示的径迹细而曲? 2020-11-26 …
请问马原的那些抽象名词有没有举例子解释的啊?比如说意识可以转化成物质,就举个例子说,桌子上有个空瓶子 2020-12-06 …
冬夜读书示子聿"示"的意思不要多,2或3个词即可! 2021-01-16 …