早教吧作业答案频道 -->化学-->
含硫化合物的转化是资源利用和环境保护的重要研究课题.(1)工业上常将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应来回收S,其物质转化如图1所示.①上述转化中,化合
题目详情
含硫化合物的转化是资源利用和环境保护的重要研究课题.
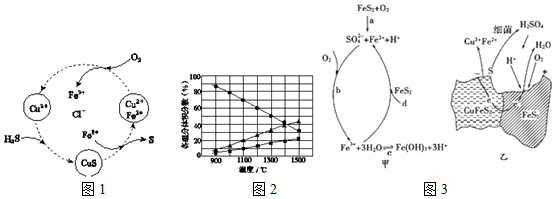
(1)工业上常将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应来回收S,其物质转化如图1所示.
①上述转化中,化合价不变的元素是___.
②上述反应中当有1mol H2S转化为硫单质时,若保持溶液中Fe3+的物质的量不变,则需消耗O2的物质的量为___.
③在不改变温度和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有___.
(2)H2S在高温下分解生成硫蒸气和H2.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,H2S在高温下分解反应的化学方程式为___.
(3)黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
①有研究者提出黄铁矿在空气中氧化的四步反应如图3甲所示.其中d步发生反应的离子方程式是___.
②用细菌冶铜时,当黄铜矿中伴有黄铁矿,由于原电池效应可明显提高黄铜矿浸取速率,其原理如图3乙所示.
a.冶炼过程中,正极周围溶液的pH___(填“增大”、“减小”或“不变”).
b.黄铜矿作负极,其产生单质硫的电极反应式为___.

(1)工业上常将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应来回收S,其物质转化如图1所示.
①上述转化中,化合价不变的元素是___.
②上述反应中当有1mol H2S转化为硫单质时,若保持溶液中Fe3+的物质的量不变,则需消耗O2的物质的量为___.
③在不改变温度和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有___.
(2)H2S在高温下分解生成硫蒸气和H2.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,H2S在高温下分解反应的化学方程式为___.
(3)黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
①有研究者提出黄铁矿在空气中氧化的四步反应如图3甲所示.其中d步发生反应的离子方程式是___.
②用细菌冶铜时,当黄铜矿中伴有黄铁矿,由于原电池效应可明显提高黄铜矿浸取速率,其原理如图3乙所示.
a.冶炼过程中,正极周围溶液的pH___(填“增大”、“减小”或“不变”).
b.黄铜矿作负极,其产生单质硫的电极反应式为___.
▼优质解答
答案和解析
(1)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故答案为:Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=
=0.5mol,故答案为:0.5mol;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,故答案为:提高混合气体中空气的比例;
(2)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S
2H2+S2,故答案为:2H2S
2H2+S2;
(3)①d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根,离子反应方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
②a、正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,故答案为:增大;
b、负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2-4e-=Cu2++Fe2++2S,故答案为:CuFeS2-4e-=Cu2++Fe2++2S.
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=
| 1mol |
| 2 |
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,故答案为:提高混合气体中空气的比例;
(2)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S
| ||
| ||
(3)①d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根,离子反应方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
②a、正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,故答案为:增大;
b、负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2-4e-=Cu2++Fe2++2S,故答案为:CuFeS2-4e-=Cu2++Fe2++2S.
看了含硫化合物的转化是资源利用和环...的网友还看了以下:
用石墨电极电解100mLH2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气 2020-04-25 …
在研究平抛物体运动的实验中,用一张印有小方格的纸记录轨迹,小方格的边长L=5cm.若小球在平抛运动 2020-05-17 …
在研究平抛运动的实验中,用一张印有小方格的纸记录轨迹,小方格边长l=1.25cm在研究平抛物体运动 2020-05-17 …
在“研究平抛运动”的试验中,用一张印有小方格的纸记录轨迹,小方格小方格的边长L=1.25cm在“研 2020-05-17 …
中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖.由青蒿素合成系列衍生物(它们的名称和代号如 2020-06-09 …
某厂废水中含5.00×10-3mol•L-1的Cr2O72-,其毒性较大.某研究性学习小组为了变废 2020-06-10 …
为了响应国家发展科技的号召,某公司计划对A、B两类科研项目投资研发.已知研发1个A类科研项目比研发 2020-06-11 …
科研人员获得一种叶绿素b完全缺失的水稻突变体,该突变体对强光照环境的适应能力更强.请回答:(l)提 2020-06-11 …
研究表明,嫁接会影响砧木和接穗(嫁接到砧木上的芽、枝等)的性状.为研究嫁接后mRNA转运的机理,科 2020-06-11 …
科研人员以大鼠神经元为材料,研究细胞外AIP对突触传递的作用.(l)在突触前神经元上给予一个电刺激 2020-06-11 …