早教吧作业答案频道 -->化学-->
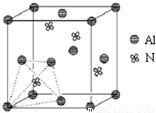
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞
题目详情
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P 3- B.Al 3+ C.Ti 4+ D.Ga 3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH 3 沸点高于AsH 3 ,其原因是NH 3 分子中共价键强度较大
(3)砷化镓可由(CH 3 ) 3 Ga和AsH 3 反应得到,该反应在700℃进行,反应的化学方程式为______
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P 3- B.Al 3+ C.Ti 4+ D.Ga 3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH 3 沸点高于AsH 3 ,其原因是NH 3 分子中共价键强度较大
(3)砷化镓可由(CH 3 ) 3 Ga和AsH 3 反应得到,该反应在700℃进行,反应的化学方程式为______

▼优质解答
答案和解析
分析:
(1)根据其基态离子核外电子排布式判断;(2)A.根据元素周期表知,硼、镓、磷、砷都属于P区元素;B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族;C.等电子体结构相似;D.含有氢键的物质沸点较大;(3)根据温度、反应物和生成物结合原子守恒写出反应方程式,根据价层电子对互斥理论确定杂化方式;(4)人们把这类(用短线表示共价键,同时用小黑点表示非键合的孤电子对)添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式;根据三溴化硼的空间构型判断分子的极性,如果是对称结构则是非极性分子,否则是极性分子.
(1)A.P3-核外有3个电子层,最外层有8个电子,故不选; B.Al3+核外有2个电子层,最外层有8个电子,故不选; C.Ti4+核外有18个电子,最外层有8个电子,故不选; D.Ga3+核外有28个电子,最外层有18个电子,故选;故选D;(2)A.除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,所以硼、镓、磷、砷都属于P区元素,故错误;B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族,所以As>Ga、Mg>Al,故正确;C.等电子体结构相似,所以砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅,故正确;D.含有氢键的物质沸点较大,氨气中存在氢键,AsH3中不含氢键,所以NH3沸点高于AsH3,故错误;故选BC;(3)在700℃时,(CH3)3Ga和AsH3反应生成GaAs和甲烷,反应方程式为:(CH3)3Ga+AsH3GaAs+3CH4,(CH3)3Ga分子中Ga原子含有3个σ键且不含孤电子对,所以Ga原子的杂化方式是sp2,A.CH4中碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故不选;B.CH2=CH2中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;C.CH≡CH中碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故不选; D.HCHO 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选; E.中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;故答案为:(CH3)3Ga+AsH3GaAs+3CH4,BDE;(4)三溴化磷分子的路易斯结构式为:,三溴化硼分子中B原子价层电子对=3+=3,且不含孤电子对,所以是平面正三角形结构,属于对称结构,正负电荷重心重合,属于非极性分子,故答案为:,非极性.
点评:
本题考查较综合,涉及杂化方式的判断、第一电离能的大小判断等知识点,难点是路易斯结构式的书写,该知识点不属于中学知识,注意第一电离能的规律及异常现象,为易错点.
分析:
(1)根据其基态离子核外电子排布式判断;(2)A.根据元素周期表知,硼、镓、磷、砷都属于P区元素;B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族;C.等电子体结构相似;D.含有氢键的物质沸点较大;(3)根据温度、反应物和生成物结合原子守恒写出反应方程式,根据价层电子对互斥理论确定杂化方式;(4)人们把这类(用短线表示共价键,同时用小黑点表示非键合的孤电子对)添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式;根据三溴化硼的空间构型判断分子的极性,如果是对称结构则是非极性分子,否则是极性分子.
(1)A.P3-核外有3个电子层,最外层有8个电子,故不选; B.Al3+核外有2个电子层,最外层有8个电子,故不选; C.Ti4+核外有18个电子,最外层有8个电子,故不选; D.Ga3+核外有28个电子,最外层有18个电子,故选;故选D;(2)A.除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,所以硼、镓、磷、砷都属于P区元素,故错误;B.同一周期第一电离能:第VA族大于第IIIA族,第IIA族大于第IIIA族,所以As>Ga、Mg>Al,故正确;C.等电子体结构相似,所以砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅,故正确;D.含有氢键的物质沸点较大,氨气中存在氢键,AsH3中不含氢键,所以NH3沸点高于AsH3,故错误;故选BC;(3)在700℃时,(CH3)3Ga和AsH3反应生成GaAs和甲烷,反应方程式为:(CH3)3Ga+AsH3GaAs+3CH4,(CH3)3Ga分子中Ga原子含有3个σ键且不含孤电子对,所以Ga原子的杂化方式是sp2,A.CH4中碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,故不选;B.CH2=CH2中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;C.CH≡CH中碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故不选; D.HCHO 中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选; E.中碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,故选;故答案为:(CH3)3Ga+AsH3GaAs+3CH4,BDE;(4)三溴化磷分子的路易斯结构式为:,三溴化硼分子中B原子价层电子对=3+=3,且不含孤电子对,所以是平面正三角形结构,属于对称结构,正负电荷重心重合,属于非极性分子,故答案为:,非极性.
点评:
本题考查较综合,涉及杂化方式的判断、第一电离能的大小判断等知识点,难点是路易斯结构式的书写,该知识点不属于中学知识,注意第一电离能的规律及异常现象,为易错点.
看了元素周期表中的第ⅢA、ⅣA、Ⅴ...的网友还看了以下:
晶体硼有10(左上)B和11(左上)B两种同位素原子构成,已知5.4克晶体硼全部转化成B2H6(硼 2020-05-12 …
硼有两种天然同位素B10和B11,硼元素的相对原子质量为10.8,则B10与B11的质量之比为多少 2020-07-05 …
硼有两种天然同位素(==打字打不出来~描述好了~汗)质量数为10的硼和质量数为11的硼,硼元素的相 2020-07-05 …
硼有两种天然同位素硼-10、硼-11,硼元素的相对原子质量为10.8,则对硼元素中硼-10的质量分 2020-07-05 …
氯化硼的熔点为10.7℃,沸点为12.5℃.在氯化硼分子中,氯-硼-氯键角为120°,它可以水解, 2020-07-05 …
新高一的三道化学问题已知硼有两种同位素10B,11B,硼元素的相对原子质量为10.8,求:1.硼元 2020-07-05 …
硼及其化合物在现代工业、生活和国防中有重要应用价值.(1)硼原子的电子排布式是.(2)最简单的硼烷 2020-07-29 …
氯化硼的熔点为10.7℃,沸点为12.5℃。在氯化硼分子中,Cl—B—Cl键角为120°,它可以水 2020-07-29 …
氮化硼是由氮原子和硼原子所构成的晶体,其组成为43.6%的硼和56.4%的氮(质量分数),有多种不 2020-07-29 …
据如图信息,回答:(1)硼原子的相对原子质量,图中X=.(2)硼元素属于(填“金属”或“非金属”)元 2021-01-12 …