早教吧作业答案频道 -->化学-->
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化
题目详情
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是___.
(2)由C、D形成的一种淡黄色固体的电子式___;含有的化学键类型有___.
(3)G元素的单质有毒,可用D的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___.
(4)将两份足量的E单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成的气体的体积比为___.
(5)由A、B、C所形成的常见离子化合物是___(写化学式),该化合物与D的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___.
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如图,该白色晶体的组成(用化学式表示)为___.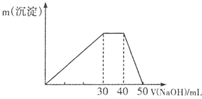
(1)七种元素中,非金属性最强的元素在周期表中的位置是___.
(2)由C、D形成的一种淡黄色固体的电子式___;含有的化学键类型有___.
(3)G元素的单质有毒,可用D的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___.
(4)将两份足量的E单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成的气体的体积比为___.
(5)由A、B、C所形成的常见离子化合物是___(写化学式),该化合物与D的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___.
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如图,该白色晶体的组成(用化学式表示)为___.

▼优质解答
答案和解析
A、B、C、D、E、F、G是原子序数依次递增的短周期元素,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F形成的化合物是造成酸雨的主要原因,则F为S元素;C和F为同一主族元素,则C为O元素;A、D同主族,D的原子序数大于氧,则D为Na;E、G处于第三周期,E是同周期中离子半径最小的元素,则E为Al,G元素的最高正化合价与最低负化合价的代数和为6,最外层电子数为7,则E为Cl;A与B、A与G形成共价化合物,则A为H元素.
(1)七种元素中,非金属性最强的元素为Cl,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)由C、D形成的一种淡黄色固体为Na2O2,其电子式为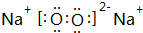 ,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,
,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,
故答案为: ;离子键和共价键;
;离子键和共价键;
(3)G元素的单质为氯气,D的最高价氧化物对应的水化物为NaOH,二者反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)等体积等浓度的硫酸和NaOH溶液,H2SO4、NaOH物质的量相等,金属Al足量,H2SO4、NaOH完全反应,设H2SO4、NaOH均为3mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=NaAlO2+3H2↑,可知生成氢气体积之比为3mol:3mol×
=2:3,
故答案为:2:3;
(5)由H、N、O所形成的常见离子化合物是NH4NO3,该化合物与NaOH的浓溶液加热时生成硝酸钠、氨气与水,反应离子方程式为:NH4++OH-
NH3↑+H2O,
故答案为:NH4NO3;NH4++OH-
NH3↑+H2O;
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为
=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×
=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,符合2n(SO42-)=3n(Al3+)+n(NH4+),溶液为硫酸铵、硫酸铝混合溶液,由于m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,应是硫酸铵、硫酸铝混合物,n(Al3+):n(NH4+)=0.01mol:0.01mol=1:1,故该混合物为:物质的量1:1的(NH4)2SO4、Al2(SO4)3混合物,
故答案为:(NH4)2SO4、Al2(SO4)3.
(1)七种元素中,非金属性最强的元素为Cl,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)由C、D形成的一种淡黄色固体为Na2O2,其电子式为
 ,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,
,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,故答案为:
 ;离子键和共价键;
;离子键和共价键;(3)G元素的单质为氯气,D的最高价氧化物对应的水化物为NaOH,二者反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)等体积等浓度的硫酸和NaOH溶液,H2SO4、NaOH物质的量相等,金属Al足量,H2SO4、NaOH完全反应,设H2SO4、NaOH均为3mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=NaAlO2+3H2↑,可知生成氢气体积之比为3mol:3mol×
| 3 |
| 2 |
故答案为:2:3;
(5)由H、N、O所形成的常见离子化合物是NH4NO3,该化合物与NaOH的浓溶液加热时生成硝酸钠、氨气与水,反应离子方程式为:NH4++OH-
| ||
故答案为:NH4NO3;NH4++OH-
| ||
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为
| 4.66g |
| 233g/mol |
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×
| 1 |
| 3 |
故答案为:(NH4)2SO4、Al2(SO4)3.
看了已知A、B、C、D、E、F、G...的网友还看了以下:
有A、B、C三种盐水,按A与B数量比为2:1混合,得到浓度为13%的盐水;按A与B的数量之比为1: 2020-05-20 …
DMA数据的传送是以(30)为单位进行的。A.字节B.字C.数据块D.位 2020-05-26 …
有A、B、C三种盐水,按A与B数量比为2:1混合,得到浓度为13%的盐水;按A与B的数量之比为1: 2020-06-03 …
有A、B、C三种盐水,按A与B数量比为2:1混合,得到浓度为13%的盐水;按A与B的数量之比为1: 2020-07-26 …
有A、B、C三种盐水,按A与B数量比为2:1混合,得到浓度为13%的盐水;按A与B的数量之比为1: 2020-07-26 …
下图中的40°线为纬线,a、b、c为等温线,甲为河流,其所在的地区常年受西风的控制。1.图中等温线a 2020-11-02 …
有A、B、C三种盐水,按A与B数量比为2:1混合,得到浓度为13%的盐水;按A与B的数量之比为1:2 2020-11-06 …
毕达哥拉斯学派认为万物的本源是:()(3.00分)A.气B.火C.数D.土答案已经出来了,B火 2020-11-15 …
下列各项中成语运用正确的一项是()A.春日的午后,我们一起去郊外踏青,享受大自然的天伦之乐B.大家认 2020-12-01 …
(2014•浙江模拟)如图为北京时间某时刻M、N两条纬线上不同地点的太阳高度的变化.图中a、b、c数 2020-12-14 …