早教吧作业答案频道 -->化学-->
我国钾长石(KAlSi3O8)的资源比较丰富.工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl(l)+KAlSi3O8(s)⇌KCl(l)+NaAlSi3O8(s).完成下列填空:(1)硅原子的核外电子占据了
题目详情
我国钾长石(KAlSi3O8)的资源比较丰富.工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l)+KAlSi3O8(s)⇌KCl (l)+NaAlSi3O8(s).
完成下列填空:
(1)硅原子的核外电子占据了___个轨道,有___种能量.
(2)上述反应中涉及到的两种非金属元素单质熔点高低顺序是___大于___,原因是___.
(3)反应中涉及到的六种元素中,具有氖原子电子层结构的简单离子的半径按从小到大的顺序排列___;位于同一周期的四种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素的名称是___.
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)
(4)一定条件下该反应在容积为2L的容器内反应,20min时达到平衡,生成N20.4mol,则平均反应速率υ(NO)=___mol/L•min.能够说明反应达到平衡状态的是___.
a.气体密度不变 b.气体颜色不变 c.υ(NO)正=2υ(N2)逆 d.平均式量不变
(5)上述反应的平衡常数表达式是___,其中非极性分子的电子式是___.
(6)反应达到平衡后,其它条件不变,升高温度,速率υ(N2)逆___平衡常数K___.(“增大”“减小”“不变”“无法确定”)
完成下列填空:
(1)硅原子的核外电子占据了___个轨道,有___种能量.
(2)上述反应中涉及到的两种非金属元素单质熔点高低顺序是___大于___,原因是___.
(3)反应中涉及到的六种元素中,具有氖原子电子层结构的简单离子的半径按从小到大的顺序排列___;位于同一周期的四种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素的名称是___.
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)
(4)一定条件下该反应在容积为2L的容器内反应,20min时达到平衡,生成N20.4mol,则平均反应速率υ(NO)=___mol/L•min.能够说明反应达到平衡状态的是___.
a.气体密度不变 b.气体颜色不变 c.υ(NO)正=2υ(N2)逆 d.平均式量不变
(5)上述反应的平衡常数表达式是___,其中非极性分子的电子式是___.
(6)反应达到平衡后,其它条件不变,升高温度,速率υ(N2)逆___平衡常数K___.(“增大”“减小”“不变”“无法确定”)
▼优质解答
答案和解析
(1)硅原子最外层含有4个电子,两个2s电子、两个2p电子,2s能级含有一个轨道,2p能级有3个轨道,2个电子占据2s能级,两个电子占据2p能级上两个轨道,所以硅原子的最外层电子占据了3个轨道,同一能级上电子能量相同,有2种能量,故答案为:3;2;
(2)Cl2是分子晶体,Si是原子晶体,原子晶体的熔点明显高于分子晶体,则单质熔点高低顺序是Si>Cl2,
故答案是:Si;Cl2;原子晶体Si的熔点明显高于分子晶体Cl2的熔点;
(3)O、Na、Al的核电荷数递增,Na+、Al3+、O2-具有氖原子电子层结构,结合核电荷数越大其简单离子的半径越小,离子半径从小到大的顺序排列为Al3+、Na+、O2-,参与上述反应且位于同一周期的几种元素中,其最高价氧化物的水化物为酸或碱,酸或碱反应生成盐和水,只有氢氧化钠能和其它三种元素的最高价氧化物的水化物反应,则该元素为Na,故答案为:Al3++2-;钠;
(4)υ(NO)=
v(N2)=
×
=0.005mol/(L•min);
a.因容器的体积不变,气体的质量不变,气体密度不变不能作为判断是否平衡的依据,但平衡时密度一定不变,故a不选;
b.气体颜色不变,说明浓度不变,可说明达到平衡状态,故b选;
c.υ(NO)正=2υ(N2)逆,正逆反应速率不等,不能达到平衡状态,故c不选;
d.气体的总质量始终不变,反应前后气体总物质的量改变,平均式量不变,说明达到平衡状态,故d选;
故答案为:0.005;bd;
(5)反应2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)平衡常数的表达式K=
,N2是只有非极性键构成的非极性分子,其电子式为: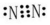 ;
;
答案为:
;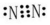 ;
;
(6)温度升高,反应速率加快,速率υ(N2)逆增大,但不知道此反应正方向是吸热还是放热,无法判断升高温度时平衡移动的方向,
平衡常数无法确定是增大还是减小;
答案为:增大;无法确定.
(2)Cl2是分子晶体,Si是原子晶体,原子晶体的熔点明显高于分子晶体,则单质熔点高低顺序是Si>Cl2,
故答案是:Si;Cl2;原子晶体Si的熔点明显高于分子晶体Cl2的熔点;
(3)O、Na、Al的核电荷数递增,Na+、Al3+、O2-具有氖原子电子层结构,结合核电荷数越大其简单离子的半径越小,离子半径从小到大的顺序排列为Al3+、Na+、O2-,参与上述反应且位于同一周期的几种元素中,其最高价氧化物的水化物为酸或碱,酸或碱反应生成盐和水,只有氢氧化钠能和其它三种元素的最高价氧化物的水化物反应,则该元素为Na,故答案为:Al3+
(4)υ(NO)=
| 1 |
| 2 |
| ||
| 20min |
| 1 |
| 2 |
a.因容器的体积不变,气体的质量不变,气体密度不变不能作为判断是否平衡的依据,但平衡时密度一定不变,故a不选;
b.气体颜色不变,说明浓度不变,可说明达到平衡状态,故b选;
c.υ(NO)正=2υ(N2)逆,正逆反应速率不等,不能达到平衡状态,故c不选;
d.气体的总质量始终不变,反应前后气体总物质的量改变,平均式量不变,说明达到平衡状态,故d选;
故答案为:0.005;bd;
(5)反应2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g)平衡常数的表达式K=
| c2(N2)×c3(H2O) |
| c2(NH3)×c(NO)×c(NO2) |
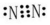 ;
;答案为:
| c2(N2)×c3(H2O) |
| c2(NH3)×c(NO)×c(NO2) |
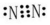 ;
;(6)温度升高,反应速率加快,速率υ(N2)逆增大,但不知道此反应正方向是吸热还是放热,无法判断升高温度时平衡移动的方向,
平衡常数无法确定是增大还是减小;
答案为:增大;无法确定.
看了我国钾长石(KAlSi3O8)...的网友还看了以下:
是GREOG上set3的第14题,看不懂解析.S是所有正整数n的集合,n满足n²同时是24和108 2020-05-22 …
记账凭证的填制,除了应符合填制原始凭证的各项要求外,还应符合下列要 求:( )A.凭证摘要简明### 2020-05-30 …
急,几道高中数学题(命题及其关系)!1、如果A是B的充分条件,则B是A的()条件;非A是非B的() 2020-06-03 …
高中数学题(非常反感的一块知识,感觉象绕口令,呵呵)已知P是R的充分而不必要条件,Q是R充分条件, 2020-06-06 …
0.05mol硫酸含有 molH原子,molS原子,molO原子,含有 个H原子,个S原子,个O原 2020-06-27 …
填空题一道在一定条件下,原子可以失去或得到电子,成为带电荷的(),如氯原子与纳原子接近时,氯原子会 2020-07-01 …
事件与基本事件空间(1)不可能事件:在条件S下,的事件,叫做相对于事件S的不可能事件,简称不可能事件 2020-11-03 …
如图甲所示,渔民看到水中S′处有一条鱼,为了叉到鱼,他们不是对准图乙中的S′,而是对准位置更深的S叉 2020-12-29 …
高中化学问题求解![Fe(SCN)3+]中,S原子上有3对孤电子对,进入Fe3+的空轨道,但是只有1 2021-01-04 …
化学一条填空题和一条问答题分别将盛有浓盐酸,浓硫酸,浓硝酸,的烧杯露置於空气中,放置一段时间后,质量 2021-01-22 …