早教吧作业答案频道 -->化学-->
根据有关能量变化关系图,回答下列问题.(1)①根据图1A,写出反应的热化学方程式:.②根据如图1B所示情况,判断下列说法中正确的是.A.其热化学方程式为CO(g)+H2O(g)═CO2
题目详情
根据有关能量变化关系图,回答下列问题.
(1)①根据图1A,写出反应的热化学方程式:___.
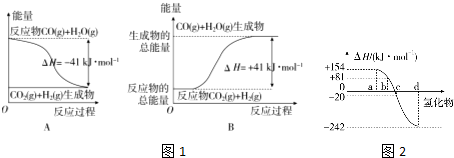
②根据如图1B所示情况,判断下列说法中正确的是___.
A.其热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ•mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其△H>+41kJ•mol-1
(2)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是___.
(3)如图2表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素.
①非金属元素氢化物的稳定性与氢化物生成热△H的关系为___.
②写出硒化氢发生分解反应的热化学方程式___.
(1)①根据图1A,写出反应的热化学方程式:___.

②根据如图1B所示情况,判断下列说法中正确的是___.
A.其热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ•mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其△H>+41kJ•mol-1
(2)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是___.
(3)如图2表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素.
①非金属元素氢化物的稳定性与氢化物生成热△H的关系为___.
②写出硒化氢发生分解反应的热化学方程式___.
▼优质解答
答案和解析
(1)图象分析可知为放热反应,反应的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
②图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,
A.将反应的反应物与生成物弄反了,该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,故A错误;
B.生成物的能量比反应物的能量高,故该反应为吸热反应,故B正确;
C.生成物的能量比反应物的能量高,故该反应为吸热反应,故C错误;
D.因为气态水变成液态水还要放热,当H2O为液态时,其反应热值大于41kJ/mol,则△H<+41kJ•mol-1,故D错误;
故答案为:B;
(2)16g固体硫完全燃烧时放出148.4kJ的热量,则1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
②图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,
A.将反应的反应物与生成物弄反了,该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,故A错误;
B.生成物的能量比反应物的能量高,故该反应为吸热反应,故B正确;
C.生成物的能量比反应物的能量高,故该反应为吸热反应,故C错误;
D.因为气态水变成液态水还要放热,当H2O为液态时,其反应热值大于41kJ/mol,则△H<+41kJ•mol-1,故D错误;
故答案为:B;
(2)16g固体硫完全燃烧时放出148.4kJ的热量,则1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
看了根据有关能量变化关系图,回答下...的网友还看了以下:
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH 2020-04-09 …
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH 2020-04-09 …
1、2.71gNaSO2.H2O中含有Na+和SO42-的物质的梁是多少?含H2O的数目为多少?2 2020-05-13 …
马上就要过期不候一、1摩尔H2O含有个水分子,H2O中有个氧原子,个氢原子,1摩尔H2O含有摩尔氧 2020-06-22 …
老师讲的氨与盐溶液反应有的方程式写成和NH3·H2O反应,有的写得和NH3反应,为什么呢?例如:A 2020-07-03 …
关于水合氢离子和氨根离子的问题NH3+H3O+=H2O+NH4+这个化学反应方程式为什么不能证明N 2020-07-14 …
已知反应:2NO2+2NaOH→NaNO3+NaNO2+H2O;NO+NO2+2NaOH→2NaN 2020-07-20 …
为了防止NO,NO2,N2O4对大气的污染,常用氢氧化钠溶液进行吸收处理,反应的化学方程式2NO2 2020-07-24 …
化学反应中生成物由于温度太高而汽化成气体要不要标“↑”比如H2+CuO=Cu+H2O中的水会因温度高 2020-11-05 …
德国化学家李比希测定烃类有机物组成的装置,氧化铜做催化剂,在750℃左右使有机物在氧气流中全部氧化为 2020-12-01 …