早教吧作业答案频道 -->化学-->
硫酸是一种应用非常广泛的化工原料,其生产工艺与原料有紧密关系.目前主要有如下图所示的两种工艺:(1)H2SO4的用途非常广泛,可应用于下列哪些方面(填序号)A.过磷酸钙的制备
题目详情
硫酸是一种应用非常广泛的化工原料,其生产工艺与原料有紧密关系.目前主要有如下图所示的两种工艺: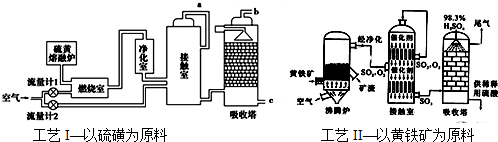
(1)H2SO4的用途非常广泛,可应用于下列哪些方面___(填序号)
A.过磷酸钙的制备 B.铅蓄电池的生产
C.橡胶的硫化 D.表面活性剂“烷基苯磺酸钠”的合成
(2)若沸腾炉中每燃烧0.12Kg FeS2会放出853KJ热量,写出此状况下FeS2燃烧的热化学方程式___.
(3)两工艺中都用了接触室和吸收塔,为充分利用反应放出的热量,接触室中要安装___(填设备名称).从吸收塔出来的尾气一般要进行的一种处理是___
(4)下列操作与操作的主要原因都正确的是___填序号)
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.SO3从吸收塔底部通入,因为吸收SO3采取逆流的形式
C.SO2氧化为SO3时需要使用催化剂,这样可提高SO2转化率
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,提高SO3吸收率
(5)为使硫黄充分燃烧,经流量计1 通入燃烧室的氧气过量50%,为提高SO2 转化率,经流量计2 的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5 倍,则生产过程中流经流量计1 和流量计2 的空气体积比应为___(空气中氧气的体积分数按0.2计).
(6)工艺I与工艺 II相比,主要差异为___(填序号).
A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂
(7)若浓硫酸吸收SO3得到H2SO4•SO3,则将1Kg 98%的浓硫酸充分吸收SO3后所得产物进行稀释,
可以得到___Kg 98%的浓硫酸.

(1)H2SO4的用途非常广泛,可应用于下列哪些方面___(填序号)
A.过磷酸钙的制备 B.铅蓄电池的生产
C.橡胶的硫化 D.表面活性剂“烷基苯磺酸钠”的合成
(2)若沸腾炉中每燃烧0.12Kg FeS2会放出853KJ热量,写出此状况下FeS2燃烧的热化学方程式___.
(3)两工艺中都用了接触室和吸收塔,为充分利用反应放出的热量,接触室中要安装___(填设备名称).从吸收塔出来的尾气一般要进行的一种处理是___
(4)下列操作与操作的主要原因都正确的是___填序号)
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.SO3从吸收塔底部通入,因为吸收SO3采取逆流的形式
C.SO2氧化为SO3时需要使用催化剂,这样可提高SO2转化率
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,提高SO3吸收率
(5)为使硫黄充分燃烧,经流量计1 通入燃烧室的氧气过量50%,为提高SO2 转化率,经流量计2 的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5 倍,则生产过程中流经流量计1 和流量计2 的空气体积比应为___(空气中氧气的体积分数按0.2计).
(6)工艺I与工艺 II相比,主要差异为___(填序号).
A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂
(7)若浓硫酸吸收SO3得到H2SO4•SO3,则将1Kg 98%的浓硫酸充分吸收SO3后所得产物进行稀释,
可以得到___Kg 98%的浓硫酸.
▼优质解答
答案和解析
(1)A.过磷酸钙的制取过程中需要浓硫酸和磷矿石,故A正确;
B.铅蓄电池中需要用到硫酸作电解质溶液,故B正确;
C.橡胶硫化所用到的为单质硫,故C错误;
D.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,磺化反应就是与硫酸发生的取代反应,故D正确;
故选:ABD;
(2)0.12kgFeS2就会放出853kJ热量,即1mol释放853KJ热量,则热化学方程式可写为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3412 kJ•mol-1;
(3)为了充分利用能量,接触室中要安装热交换器,从吸收塔出来的尾气二氧化硫要用石灰水、氨水吸收,
故答案为:热交换器;用石灰水或氨水吸收;
(4)A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B.SO3从吸收塔底部通入,SO3采取逆流的形式吸收更充分,故B正确;
C.一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故答案为:BD;
(5)燃烧室中的反应为S+O2
SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2⇌2SO3,则流量计2中通入氧气的体积为2.5×0.5x=1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;
故答案为:6:5;
(6)硫铁矿中铁的氧化需要消耗O2,所以硫耗氧少些,故A项正确;原料选择与SO2的转化率无关,故B项错误;用硫铁矿为原料产生的废渣较多,但废气量相同,故C项正确;用SO2制取SO3的过程中都需要使用催化剂,故D项错误,
故选:AC;
(7)98%的浓H2SO4中H2SO4、H2O的物质的量之比为
:
=1:
,故98%的浓H2SO4可以表示为SO3•
H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为
SO3•
H2O,计算浓硫酸改写后H2O的物质的量,可得
SO3•
H2O的物质的量,浓硫酸改写后H2O的物质的量为n(H2O)=1000g÷(80+
×18)×
=
mol,则
SO3•
H2O的物质的量为10mol,根据硫原子守恒,稀释后可得浓硫酸H2SO4•
H2O的质量为
mol×(98+2)g/mol=2222g,约是2.22Kg,
故答案为:2.22.
B.铅蓄电池中需要用到硫酸作电解质溶液,故B正确;
C.橡胶硫化所用到的为单质硫,故C错误;
D.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,磺化反应就是与硫酸发生的取代反应,故D正确;
故选:ABD;
(2)0.12kgFeS2就会放出853kJ热量,即1mol释放853KJ热量,则热化学方程式可写为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3412 kJ•mol-1;
(3)为了充分利用能量,接触室中要安装热交换器,从吸收塔出来的尾气二氧化硫要用石灰水、氨水吸收,
故答案为:热交换器;用石灰水或氨水吸收;
(4)A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B.SO3从吸收塔底部通入,SO3采取逆流的形式吸收更充分,故B正确;
C.一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故答案为:BD;
(5)燃烧室中的反应为S+O2
| ||
故答案为:6:5;
(6)硫铁矿中铁的氧化需要消耗O2,所以硫耗氧少些,故A项正确;原料选择与SO2的转化率无关,故B项错误;用硫铁矿为原料产生的废渣较多,但废气量相同,故C项正确;用SO2制取SO3的过程中都需要使用催化剂,故D项错误,
故选:AC;
(7)98%的浓H2SO4中H2SO4、H2O的物质的量之比为
| 98g |
| 98g•mol-1 |
| 2g |
| 18g•mol-1 |
| 1 |
| 9 |
| 10 |
| 9 |
| 20 |
| 9 |
| 10 |
| 9 |
| 20 |
| 9 |
| 10 |
| 9 |
| 10 |
| 9 |
| 10 |
| 9 |
| 100 |
| 9 |
| 20 |
| 9 |
| 10 |
| 9 |
| 1 |
| 9 |
| 200 |
| 9 |
故答案为:2.22.
看了硫酸是一种应用非常广泛的化工原...的网友还看了以下:
已知2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ/mol,则关于方程式2H2 2020-04-07 …
用细线吊起一个空的塑料饮料瓶,用手转动饮料瓶,使它绕对称轴旋转,如图所示.如果这时用电风扇向它吹风 2020-07-14 …
若曲线C上的点的坐标都是方程f(x,y)=0的解,则下面判断正确的是()A.曲线C的方程是f(x, 2020-07-21 …
下列说法正确的是()A.若一元二次方程的常数项为0,则0必是它的一个根B.方程3x2=4的常数项是 2020-07-31 …
有关我国城市道路网多为方格——环行——放射式格局的叙述,错误的是A.方格式道路网是很多城市历史文化形 2020-12-01 …
有关我国城市道路网多为方格——环行——放射式格局的叙述,错误的是A.方格式道路网是很多城市历史文化形 2020-12-01 …
二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色 2020-12-07 …
世界观和方法论是同一问题的两个方面。下列关于世界观和方法论关系表述正确的是A.方法论决定世界观B.世 2020-12-23 …
世界观和方法论是同一问题的两个方面。下列关于世界观和方法论关系表述正确的是A.方法论决定世界观B.世 2020-12-23 …
下列加粗词语的意义和用法相同的一项是[]A.方且治之——且北方之人,不习水战B.匠石之齐——沛公引兵 2021-02-09 …