早教吧作业答案频道 -->化学-->
A、B、C、D、E、F、G、I是周期表中的前36号元素,原子序数逐渐增大.A元素原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;
题目详情
A、B、C、D、E、F、G、I是周期表中的前36号元素,原子序数逐渐增大.A元素原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等; D原子p轨道上成对电子数等于未成对电子数;E离子半径是同周期元素形成的简单离子中最小的;F最高正价与最低负价的代数和为4; G是第Ⅷ族元素中原子序数最小的元素; I元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.回答下列问题:
(1)I的基态原子的电子排布式为___周期表中E属于___区.
(2)B与F形成的一种非极性分子的电子式为___;F的一种具有强还原性的氧化物分子的VSEPR模型为___
(3)一定条件下,A2气体与C2气体充分反应可生成6.8g的气体,放出18.44kJ热量,则该反应的热化学方程式为:___;生成物分子的空间构型为___.
(4)C和Na组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是___.
(5)往I的硫酸盐溶液中加入过量氨水,可生成一种配合物X,请写出该配合物中阳离子的结构简式___,在此配合物的水溶液中加入乙醇,现象是___.下列说法正确的是___
A.X中所含化学键有离子键、极性键和配位键
B.X中I2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
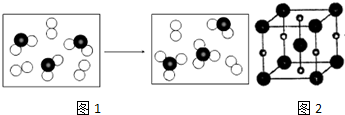
(6)如图1表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___.
(7)基态G2+离子的价电子排布式___;B和G所形成的某种晶体结构如图2所示,该晶体的化学式___.

(1)I的基态原子的电子排布式为___周期表中E属于___区.
(2)B与F形成的一种非极性分子的电子式为___;F的一种具有强还原性的氧化物分子的VSEPR模型为___
(3)一定条件下,A2气体与C2气体充分反应可生成6.8g的气体,放出18.44kJ热量,则该反应的热化学方程式为:___;生成物分子的空间构型为___.
(4)C和Na组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是___.
(5)往I的硫酸盐溶液中加入过量氨水,可生成一种配合物X,请写出该配合物中阳离子的结构简式___,在此配合物的水溶液中加入乙醇,现象是___.下列说法正确的是___
A.X中所含化学键有离子键、极性键和配位键
B.X中I2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(6)如图1表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___.
(7)基态G2+离子的价电子排布式___;B和G所形成的某种晶体结构如图2所示,该晶体的化学式___.
▼优质解答
答案和解析
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素原子的原子核内可能没有中子,则A为H元素.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等,原子核外电子排布为1s22s22p2,则B为C元素;D原子p轨道上成对电子数等于未成对电子数,外围电子排布为ns2np4,处于ⅥA族,F最高正价与最低负价的代数和为4,最外层电子数为6,故D为O元素、F为S元素;C介于碳和氧元素之间,应为N元素;E离子半径是同周期元素形成的简单离子中最小的,应为Al; G是第Ⅷ族元素中原子序数最小的元素,应为Fe元素; I元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu元素,
(1)由以上分析可知I为Cu,原子序数为29,基态原子的电子排布式为1s22s22p63s23p63d104s1,E为Al,价层电子3s23p1,位于周期表的P区,
故答案为:1s22s22p63s23p63d104s1; P;
(2)B与F形成的一种非极性分子为CS2,电子式为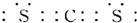 ,
,
F的一种具有强还原性的氧化物为SO2,分子中含有2个σ键,孤电子对数为
=1,分子的VSEPR模型为平面三角形,
故答案为: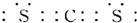 ;平面三角形;
;平面三角形;
(3)一定条件下,H2气体与N2气体充分反应可生成6.8g的气体,为NH3,物质的量为n(NH3)=
=0.4mol,放出18.44kJ热量,则生成2mol NH3放出热量为
×18.44kJ/mol=92.2kJ,
则该反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol,分子中含有3个σ键,孤电子对数为
=1,空间构型为三角锥形,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;三角锥形;
(4)N和Na组成的一种离子化合物,能与水反应生成两种碱,应是Na3N与水反应生成氢氧化钠与一水合氨,反应方程式为:Na3N+4H2O=3NaOH+NH3•H2O,
故答案为:Na3N+4H2O=3NaOH+NH3•H2O;
(5)Cu2+能与氨水形成配合物,该配合物中阳离子的结构简式:[Cu(NH3)4]2+,在此配合物的水溶液中加入乙醇,现象是有深蓝色晶体析出,
A.[Cu(NH3)4]SO4中所含化学键有离子键、极性键和配位键,故A正确;
B.[Cu(NH3)4]SO4中Cu2+提供空轨道,NH3给出孤对电子,故B错误;
C.[Cu(NH3)4]SO4的元素中第一电离能最大的是氮元素,故C错误;
D.SO42-中S原子价层电子对数=4+
=4,没有孤电子对,故SO42-为正四面体结构,SO42-与PO43-互为等电子体,PO43-也正四面体结构,故D正确,
故答案为:[Cu(NH3)4]2+;有深蓝色晶体析出;AD;
(6)图1表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,应为二氧化硫与氧气的反应,方程式为2SO2+O2⇌2SO3,
故答案为:2SO2+O2⇌2SO3;
(7)基态Fe2+离子的价电子排布式为3d6,晶胞中两种元素的原子个数分别为8×
+1=1、2×
+4×
=2,原子个数比为1:1,分子式为FeC,
故答案为:3d6;FeC.
(1)由以上分析可知I为Cu,原子序数为29,基态原子的电子排布式为1s22s22p63s23p63d104s1,E为Al,价层电子3s23p1,位于周期表的P区,
故答案为:1s22s22p63s23p63d104s1; P;
(2)B与F形成的一种非极性分子为CS2,电子式为
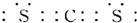 ,
,F的一种具有强还原性的氧化物为SO2,分子中含有2个σ键,孤电子对数为
| 6-2×2 |
| 2 |
故答案为:
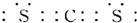 ;平面三角形;
;平面三角形;(3)一定条件下,H2气体与N2气体充分反应可生成6.8g的气体,为NH3,物质的量为n(NH3)=
| 6.8g |
| 17g/mol |
| 2mol |
| 0.4mol |
则该反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol,分子中含有3个σ键,孤电子对数为
| 5-3×1 |
| 2 |
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;三角锥形;
(4)N和Na组成的一种离子化合物,能与水反应生成两种碱,应是Na3N与水反应生成氢氧化钠与一水合氨,反应方程式为:Na3N+4H2O=3NaOH+NH3•H2O,
故答案为:Na3N+4H2O=3NaOH+NH3•H2O;
(5)Cu2+能与氨水形成配合物,该配合物中阳离子的结构简式:[Cu(NH3)4]2+,在此配合物的水溶液中加入乙醇,现象是有深蓝色晶体析出,
A.[Cu(NH3)4]SO4中所含化学键有离子键、极性键和配位键,故A正确;
B.[Cu(NH3)4]SO4中Cu2+提供空轨道,NH3给出孤对电子,故B错误;
C.[Cu(NH3)4]SO4的元素中第一电离能最大的是氮元素,故C错误;
D.SO42-中S原子价层电子对数=4+
| 6+2-2×4 |
| 2 |
故答案为:[Cu(NH3)4]2+;有深蓝色晶体析出;AD;
(6)图1表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,应为二氧化硫与氧气的反应,方程式为2SO2+O2⇌2SO3,
故答案为:2SO2+O2⇌2SO3;
(7)基态Fe2+离子的价电子排布式为3d6,晶胞中两种元素的原子个数分别为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
故答案为:3d6;FeC.
看了A、B、C、D、E、F、G、I...的网友还看了以下:
1.下列国际大都市,位于欧洲的是()A上海B东京C纽约D伦敦2.我国古代著名的教育家孔子生于公元前 2020-04-07 …
请问一个英语音标的问题,我的音标书上说:[au]合[a][u]的发音.由前元音[a]滑向后元音[u 2020-05-14 …
matlab 矩阵的每一个元素都等于前几个元素的和 如何实现如题,比如我有一个矩阵A=[2 4 8 2020-05-16 …
在长度为n的顺序存储线性表中,向第i个元素(1≤i≤n)之前插入一个新元素时,需要从后向前依次后移_ 2020-05-23 …
●对于二维数组a[1..N,1..N]中的一个元素a[i,j](1≤i,j≤N),存储在a[i,j] 2020-05-26 …
在一个长度为n的顺序表中删除第i个元素(0≤i≤n1)时,需要从前向后依次前移(33)个元素。A.n 2020-05-26 …
关于数据结构的题7.线性表中结点的个数是的,结点间的关系是的.8.向一个长度为n的向量的第i个元素 2020-06-18 …
关于英语音标我刚刚学习音标,有很多地方不明白,希望前辈指教.据说原因分为前中后元音,又可分为长短元 2020-07-22 …
8+6=3+6=i-0=6+3+2=k2-i=k2-7=kk-上=2+i-7=7+2=2+8=8+i 2020-10-30 …
某市“快女”预选中有11个评委,w位歌你的评委分是i.i,i.7,i.7,i.6,i.6,i.6,i 2021-01-02 …