早教吧作业答案频道 -->化学-->
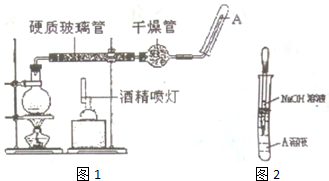
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,用如图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下Fe与水蒸气反应的
题目详情
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,用如图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下Fe与水蒸气反应的实验,请回答该实验中的问题.
(1)写出该反应的化学方程式___,8.4g铁粉参加此反应,转移电子为___mol
(2)玻璃管中石棉绒的作用是___
(3)圆底烧杯中盛装的是水,该装置受热后的主要作用是___
(4)某学习小组欲探究反应后的硬质玻璃管中固体物质中是否有过量的铁,设计了如下实验
①待硬质玻璃管冷却后,取少量其中的固体物质溶于稀硫酸的溶液A.
②分别取少量溶液A置于两支试管中.
甲同学向一支试管中按如图2所示的操作加入氢氧化钠溶液,若只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,则___(填“能”或“不能”)说明有过量的铁,写出白色沉淀最终变成红褐色沉淀的化学方程式___
乙同学向另一支试管中滴加KSCN溶液,若溶液变红色,则___(填“能”或“不能”)说明有过量的铁,若溶液未变红色,则___(填“能”或“不能”)说明有过量的铁,其未变红色的原因是___(用离子方程式表示)

(1)写出该反应的化学方程式___,8.4g铁粉参加此反应,转移电子为___mol
(2)玻璃管中石棉绒的作用是___
(3)圆底烧杯中盛装的是水,该装置受热后的主要作用是___
(4)某学习小组欲探究反应后的硬质玻璃管中固体物质中是否有过量的铁,设计了如下实验
①待硬质玻璃管冷却后,取少量其中的固体物质溶于稀硫酸的溶液A.
②分别取少量溶液A置于两支试管中.
甲同学向一支试管中按如图2所示的操作加入氢氧化钠溶液,若只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,则___(填“能”或“不能”)说明有过量的铁,写出白色沉淀最终变成红褐色沉淀的化学方程式___
乙同学向另一支试管中滴加KSCN溶液,若溶液变红色,则___(填“能”或“不能”)说明有过量的铁,若溶液未变红色,则___(填“能”或“不能”)说明有过量的铁,其未变红色的原因是___(用离子方程式表示)
▼优质解答
答案和解析
(1)Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)
Fe 3O4+4 H2,Fe的物质的量为
=0.15mol,根据方程式可知生成氢气物质的量为0.15mol×
=0.2mol,结合H元素化合价变化可知转移电子物质的量为0.2mol×2=0.4mol,
故答案为:3Fe+4H2O(g)
Fe 3O4+4 H2;0.4;
(2)玻璃管中石棉绒的作用是:作为铁粉的载体,增大与水蒸气接触面积,有利于充分反应,
故答案为:铁粉的载体,增大与水蒸气接触面积;
(3)G加入后生成水蒸气,为实验提供水蒸气,
故答案为:为实验提供水蒸气;
(4)四氧化三铁与硫酸反应生成硫酸亚铁、硫酸铁,A溶液中加入氢氧化钠溶液只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,说明溶液A中含有硫酸亚铁,没有硫酸铁,过量的Fe与铁离子反应生成亚铁离子,能说明有过量的铁,生成的氢氧化亚铁沉淀被氧化为氢氧化铁,反应离子方程式为:4Fe(OH) 2+O2+2H2O(g)=Fe(OH) 3,
向另一支试管中滴加KSCN溶液,若溶液变红色,说明溶液中含有铁离子,不能说明有过量的铁,若溶液未变红色,说明溶液中没有铁离子,过量的Fe与铁离子反应生成亚铁离子,反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:能;(OH) 2+O2+2H2O(g)=Fe(OH) 3;不能;能;Fe+2Fe3+=3Fe2+.
| ||
| 8.4g |
| 56g/mol |
| 4 |
| 3 |
故答案为:3Fe+4H2O(g)
| ||
(2)玻璃管中石棉绒的作用是:作为铁粉的载体,增大与水蒸气接触面积,有利于充分反应,
故答案为:铁粉的载体,增大与水蒸气接触面积;
(3)G加入后生成水蒸气,为实验提供水蒸气,
故答案为:为实验提供水蒸气;
(4)四氧化三铁与硫酸反应生成硫酸亚铁、硫酸铁,A溶液中加入氢氧化钠溶液只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,说明溶液A中含有硫酸亚铁,没有硫酸铁,过量的Fe与铁离子反应生成亚铁离子,能说明有过量的铁,生成的氢氧化亚铁沉淀被氧化为氢氧化铁,反应离子方程式为:4Fe(OH) 2+O2+2H2O(g)=Fe(OH) 3,
向另一支试管中滴加KSCN溶液,若溶液变红色,说明溶液中含有铁离子,不能说明有过量的铁,若溶液未变红色,说明溶液中没有铁离子,过量的Fe与铁离子反应生成亚铁离子,反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:能;(OH) 2+O2+2H2O(g)=Fe(OH) 3;不能;能;Fe+2Fe3+=3Fe2+.
看了在常温下,Fe与水并不起反应,...的网友还看了以下:
读下图,回答15-17题。15.从图中看,划分热带和温带、温带和寒带的年平均气温分别是()A.15 2020-05-14 …
反应E+F=G在温度t1下进行,反应M+N=K在温度t2下进行,已知t1>t2,且E和F的浓度均大 2020-05-20 …
下图中AB、CD为两条纬线,B、C、E位于同一经线上,A、E、D三点的太阳高度为0°,A和E的时差 2020-06-19 …
如图为物质A〜I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反 2020-06-25 …
(2009•普陀区二模)某仓库为了保持库内的湿度和温度,四周墙上均装有如图所示的自动通风设施.该设 2020-07-10 …
如表为a~d4种植物的单个植株在自然CO2浓度及最适温度下的光补偿点和光饱和点;某实验小组对另两种植 2020-10-31 …
1.已知我国浙江温岭和西藏拉萨两地纬度相近,而经度分别约为121°E和91°E.当2001年的第1缕 2021-01-14 …
(12分)根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为 2021-01-15 …
(本小题15分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常 2021-01-15 …
如图是初中化学中常见物质问的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B是产 2021-01-22 …