早教吧作业答案频道 -->化学-->
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)⇌HCOOH(l)+CH3OH(l)△H>0某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:组分HCOOC
题目详情
甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)⇌HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如图:
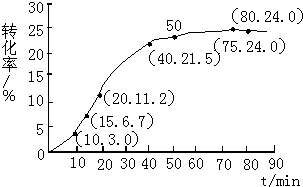
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
请计算15~20min范围内甲酸甲酯的减少量为___mol,甲酸甲酯的平均反应速率为___mol•min-1(不要求写出计算过程).
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:___.
(3)上述反应的平衡常数表达式为:K=
,则该反应在温度T1下的K值为___.
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
HCOOCH3(l)+H2O(l)⇌HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:___.
(3)上述反应的平衡常数表达式为:K=
| c(HCOOH)•c(CH3OH) |
| c(HCOOCH3)•c(H2O) |
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
▼优质解答
答案和解析
(1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%=0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%=0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol/5min=0.009mol•min-1.
故答案为:0.045;0.009;
(2)从题给数据不难看出,平均速率的变化随转化率的增大先增大再减小,后保持不变.因为反应开始甲酸甲酯的浓度大,所以反应速率较大,后随着反应进行甲酸甲酯的浓度减小,反应速率减小,当达到平衡时,反应速率几乎不变,其规律及原因如下:
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零,
故答案为:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)由图象与表格可知,在75min时达到平衡,甲酸甲酯的转化率为24%,所以甲酸甲酯转化的物质的量为1.00×24%=0.24mol,结合方程式可计算得平衡时,甲酸甲酯物质的量=0.76mol,水的物质的量1.75mol,甲酸的物质的量=0.25mol,甲醇的物质的量=0.76mol.所以K=(0.76×0.25)/(1.75×0.76)=1/7.
故答案为:
;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率增大,所以绘图时要注意T2达到平衡时的平台要高于T1.图象为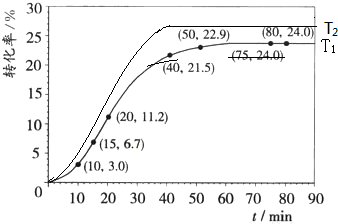 ,
,
故答案为:
故答案为:0.045;0.009;
(2)从题给数据不难看出,平均速率的变化随转化率的增大先增大再减小,后保持不变.因为反应开始甲酸甲酯的浓度大,所以反应速率较大,后随着反应进行甲酸甲酯的浓度减小,反应速率减小,当达到平衡时,反应速率几乎不变,其规律及原因如下:
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零,
故答案为:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)由图象与表格可知,在75min时达到平衡,甲酸甲酯的转化率为24%,所以甲酸甲酯转化的物质的量为1.00×24%=0.24mol,结合方程式可计算得平衡时,甲酸甲酯物质的量=0.76mol,水的物质的量1.75mol,甲酸的物质的量=0.25mol,甲醇的物质的量=0.76mol.所以K=(0.76×0.25)/(1.75×0.76)=1/7.
故答案为:
| 1 |
| 7 |
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率增大,所以绘图时要注意T2达到平衡时的平台要高于T1.图象为
 ,
,故答案为:

看了甲酸甲酯水解反应方程式为:HC...的网友还看了以下:
阅读下面这首诗,然后回答问题。(8分)客发笤溪清叶燮客心如水水如愁,容易归舟趁疾流。忽讶船窗送吴语 2020-05-17 …
卷地风来忽吹散,望湖楼下水如天的意思我要的是最后两句的(卷地风来忽吹散,望湖楼下水如天)(财富悬赏 2020-06-07 …
诗歌赏析1.“客心如水水如愁”是如何表现“愁”的?2.诗歌末联两句表达诗人怎样心情?客发笤溪客心如 2020-06-21 …
闷热的夜,令人窒息,忽然,电闪,雷鸣,雨水如注将这句扩写闷热的夜,令人窒息,忽然... 2020-06-29 …
“卷地风来忽吹散,望湖楼下水如天”是描写西湖什么的诗句?“卷地风来忽吹散,望湖楼下水如天”这两句诗 2020-06-30 …
鼓韵阅读答案1.文章标题是鼓韵,请仔细阅读全文,说说商河鼓子秧歌的独特韵味体现在哪些方面?2.③段 2020-07-08 …
下列语句中属于描述气候的是()A、山前桃花山后雪B、忽如一夜春风来,千树万树梨花开C、轮台九月风夜 2020-07-15 …
阅读古诗,完成练习六月二十七日望湖楼醉书宋苏轼黑云翻墨未遮山,白雨跳珠乱入船.卷地风来忽吹散,望湖楼 2020-11-29 …
形容水波忽明忽暗的样子水波忽明忽暗的成语是什么? 2020-12-15 …
1.在我国的古诗中,有许多描写天气与气候的诗句.下列句子中,反映气候的是A.羌笛何须怨杨柳,春风不度 2021-01-30 …