COCl2的分解反应为COCl2(g)Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10mim到14min的COCl2浓度
COCl 2 的分解反应为 COCl 2 (g) Cl 2 (g) + CO(g) Δ H =+ 108 kJ·mol - 1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示 ( 第 10 mim 到 14 min 的 COCl 2 浓度变化曲线未示出 ) :
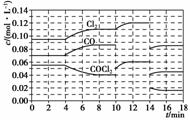
(1) 计算反应在第 8 min 时的平衡常数 K = ________ ;
(2) 比较第 2 min 反应温度 T (2) 与第 8 min 反应温度 T (8) 的高低: T (2)________ T (8)( 填 “<”“>” 或 “ =” ) ;
(3) 若 12 min 时反应于温度 T (8) 下重新达到平衡,则此时 c (COCl 2 ) = ________mol·L - 1 ;
(4) 比较产物 CO 在 2 ~ 3 min 、 5 ~ 6 min 和 12 ~ 13 min 时平均反应速率 [ 平均反应速率为分别以 v (2 ~ 3) 、 v (5 ~ 6) 、 v (12 ~ 13) 表示 ] 的大小 ________ ;
(5) 比较反应物 COCl 2 在 5 ~ 6 min 和 15 ~ 16 min 时平均反应速率的大小:
v (5 ~ 6)________ v (15 ~ 16)( 填 “<”“>” 或 “ = ”) ,原因是 __________________________________________________________________ 。
解析 (1) c (Cl 2 ) = 0.11 mol·L - 1 、 c (CO) = 0.085 mol·L - 1 、 c (COCl 2 ) = 0.04 mol·L - 1 ,代入 K = ![]() ≈ 0.234 mol · L - 1 ; (2) 第 4 min 时, Cl 2 与 CO 的浓度均逐渐增大,再结合此反应正向为吸热反应,所以第 4 min 时改变的条件一定是升高温度,故 T (2)< T (8) ; (3) 用平衡常数进行求解,此温度下 K =
≈ 0.234 mol · L - 1 ; (2) 第 4 min 时, Cl 2 与 CO 的浓度均逐渐增大,再结合此反应正向为吸热反应,所以第 4 min 时改变的条件一定是升高温度,故 T (2)< T (8) ; (3) 用平衡常数进行求解,此温度下 K = ![]() = 0.234 mol · L - 1 =
= 0.234 mol · L - 1 = ![]() 可知 c (COCl 2 ) ≈ 0.031 mol · L - 1 ; (4) 依据 v (CO) =
可知 c (COCl 2 ) ≈ 0.031 mol · L - 1 ; (4) 依据 v (CO) = ![]() 可知 v (2 ~ 3) = v (12 ~ 13) = 0 ; (5) 由图像可知上面的两个曲线是生成物浓度变化曲线、下面的曲线为 COCl 2 浓度变化曲线, c (COCl 2 ) =
可知 v (2 ~ 3) = v (12 ~ 13) = 0 ; (5) 由图像可知上面的两个曲线是生成物浓度变化曲线、下面的曲线为 COCl 2 浓度变化曲线, c (COCl 2 ) = ![]() , 5 ~ 6 min 时的 Δ c (COCl 2 ) 大于 15 ~ 16 min 时的,所以 v (5 ~ 6)> v (15 ~ 16) ;应从影响化学反应速率的因素入手分析,由图像可知 4 ~ 18 分钟温度相同,只能从浓度角度分析。
, 5 ~ 6 min 时的 Δ c (COCl 2 ) 大于 15 ~ 16 min 时的,所以 v (5 ~ 6)> v (15 ~ 16) ;应从影响化学反应速率的因素入手分析,由图像可知 4 ~ 18 分钟温度相同,只能从浓度角度分析。
答案 (1)0.234 mol·L - 1 (2)< (3)0.031
(4) v (5 ~ 6)> v (2 ~ 3) = v (12 ~ 13)
(5)> 在相同温度时,该反应的反应物浓度越高,反应速率越大
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)C(g)+D(g 2020-05-14 …
请师父帮下忙我比较菜一定条件下在容积只有2L的密闭容器中,加入一定量的A,发生如下反应,在达到平衡 2020-05-23 …
如果下面的DNA双螺旋从左向右进行转录,指出那条链是编码链.并写出转录产物的顺序?5’-A-T-C 2020-06-26 …
下列对双链DNA的叙述不正确的是A.若一条链A和T的数目相等,则另一链A和T的数目也相等B.若一条 2020-06-26 …
反应c(s)+h2o(g)可逆符号co(g)+h2(g)在溶剂可变的密闭容器中进行,在其他条件不变的 2020-11-03 …
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反 2020-11-03 …
碱基计算的规律.①A等于T,G等于C,A+G=T+CA+G/T+C等1.②一条单链的A+G/T+C的 2020-11-27 …
在下表空白处填写改变某一条件(反应在密闭体系中进行,并假设其它条件不变)对以下反应的反应速率和化学平 2020-12-15 …
1.反应A(g)+B(g)3C(g)-Q.达到平衡时,下列条件中能使平衡向左移动的是A.加催化剂B. 2020-12-23 …
下列变化中所涉及的物质都是初中化学常见的物质,已知A、B常温下为液态,C、G为单质,B是相对分子质量 2021-01-11 …