早教吧作业答案频道 -->化学-->
中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量.①下列滴定装置图1中
题目详情
中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等.
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量.
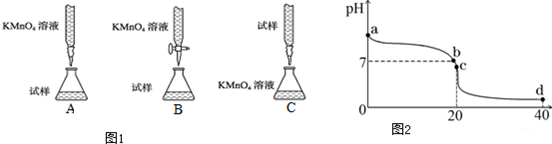
①下列滴定装置图1中(夹持部分略去),最合理的是:___.
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管、量筒外,还需要___(填仪器名称).
(2)常温下,探究小组乙将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图2所示.
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=___.
②b点处溶液中c (Cl-)___c (NH4+)(填“>”、“<”或“=”).
③取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置.写出实验现象并用必要的文字和相关离子方程式给予解释:___.
④d点所示溶液中离子浓度由大到小的排序是___.
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量.
①下列滴定装置图1中(夹持部分略去),最合理的是:___.

②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、玻璃棒、烧杯、胶头滴管、量筒外,还需要___(填仪器名称).
(2)常温下,探究小组乙将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图2所示.
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=___.
②b点处溶液中c (Cl-)___c (NH4+)(填“>”、“<”或“=”).
③取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置.写出实验现象并用必要的文字和相关离子方程式给予解释:___.
④d点所示溶液中离子浓度由大到小的排序是___.
▼优质解答
答案和解析
(1)①用酸性KMnO4溶液滴定某补血剂,高锰酸钾具有强氧化性,能氧化橡胶管,不能用碱式滴定管,所以B符合;
故选:B;
②配制一定物质的量浓度的酸性KMnO4溶液250mL的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,将洗涤液移入容量瓶,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;所以需要的仪器为托盘天平、药匙、玻璃棒、烧杯、量筒(可用可不用),250mL容量瓶、胶头滴管,还必须使用的玻璃仪器为:250mL容量瓶;
故答案为:250mL容量瓶;
(2)①一水合氨是弱电解质,在水溶液里只有部分电离,电离出氢氧根离子和铵根离子,一水合氨的电离方程式为:NH3•H2O⇌NH4++OH-,离子积常数=c(H+)c(OH-),假设溶液的pH=10,则水电离出的氢离子浓度为10-10mol/L,
故答案为:10-10mol/L;
②b点时pH=7,则溶液中cc(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(NH4+)+cc(H+),所以得c(Cl-)=c(NH4+),故答案为:=;
③c点时二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为:NH4++H2O⇌NH3•H2O+H+,取c点时的饱和溶液并向其加入水玻璃,硅酸根离子水解显碱性,铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O=H2SiO3↓+2NH3•H2O;
故答案为:铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O=H2SiO3↓+2NH3•H2O;
④d点时,酸的物质的量是氨水的2倍,二者混合时,溶液中的溶质为等物质的量浓度的氯化铵和盐酸,溶液呈酸性,氯化氢完全电离,铵根离子水解但水解程度较小,结合物料守恒知,溶液中离子浓度大小顺序是c (Cl-)>c (H+)>c (NH4+)>c (OH-),
故答案为:c(Cl-)>c(H+)>c(NH4+)>c(OH-).
故选:B;
②配制一定物质的量浓度的酸性KMnO4溶液250mL的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,将洗涤液移入容量瓶,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;所以需要的仪器为托盘天平、药匙、玻璃棒、烧杯、量筒(可用可不用),250mL容量瓶、胶头滴管,还必须使用的玻璃仪器为:250mL容量瓶;
故答案为:250mL容量瓶;
(2)①一水合氨是弱电解质,在水溶液里只有部分电离,电离出氢氧根离子和铵根离子,一水合氨的电离方程式为:NH3•H2O⇌NH4++OH-,离子积常数=c(H+)c(OH-),假设溶液的pH=10,则水电离出的氢离子浓度为10-10mol/L,
故答案为:10-10mol/L;
②b点时pH=7,则溶液中cc(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(NH4+)+cc(H+),所以得c(Cl-)=c(NH4+),故答案为:=;
③c点时二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为:NH4++H2O⇌NH3•H2O+H+,取c点时的饱和溶液并向其加入水玻璃,硅酸根离子水解显碱性,铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O=H2SiO3↓+2NH3•H2O;
故答案为:铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O=H2SiO3↓+2NH3•H2O;
④d点时,酸的物质的量是氨水的2倍,二者混合时,溶液中的溶质为等物质的量浓度的氯化铵和盐酸,溶液呈酸性,氯化氢完全电离,铵根离子水解但水解程度较小,结合物料守恒知,溶液中离子浓度大小顺序是c (Cl-)>c (H+)>c (NH4+)>c (OH-),
故答案为:c(Cl-)>c(H+)>c(NH4+)>c(OH-).
看了中学化学常见的滴定法包括中和滴...的网友还看了以下:
下列说法中正确的是()A.非金属氧化物一定能与碱发生反应B.金属氧化物一定不能与碱发生反应C.酸性 2020-05-02 …
下列说法正确的是()A.非金属氧化物都是酸性氧化物B.凡是酸性氧化物都可直接与水反应生成对应的酸C 2020-05-02 …
下列叙述正确的是()A.能与水反应生成酸的氧化物叫做酸性氧化物B.碱性氧化物一定是金属氧化物C.能 2020-05-13 …
下列说法中不正确的是()A.可用氯化钡溶液区分稀盐酸和稀硫酸B.硝酸铵溶于水制成的冰袋可用于给发烧 2020-05-14 …
混合物是由混合而成的,如空气;纯净物只由组成,如氧气、氮气等.纯净物有固定组成,混合物没有固定组成 2020-05-14 …
抗禽流感药物达菲可用莽草酸为原料合成.莽草酸结构简式如图.下列说法正确的是()A.莽草酸的化学式为 2020-07-06 …
生活中常见的柠檬汁、蕃茄汁,柑桔汁、酸奶等物质的水溶液都有一定的酸性,这是由于它们[]A.溶于水时 2020-07-10 …
下列叙述中能证明次氯酸是一种弱酸的是A.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸B.次氯酸是一种强氧 2020-07-13 …
爱动脑筋的小亮在实验室对放置已久的亚硫酸钠(Na2SO3)的样品成分开展了探究:查阅资料1.亚硫酸钠 2020-12-01 …
“细节决定成败”化学实验中尤其要注重细节.下列实验操作或设计正确的是()A.检验生成的气体是CO2B 2020-12-18 …