早教吧作业答案频道 -->化学-->
工业上制备补血剂常用碳酸亚铁,某兴趣小组对碳酸亚铁的制备与性质进行探究.(1)利用如图1装置制备碳酸亚铁:①装置中仪器A的名称为.实验时要配制100mL4mol•L-1H2SO4溶液,需用98%
题目详情
工业上制备补血剂常用碳酸亚铁,某兴趣小组对碳酸亚铁的制备与性质进行探究.
(1)利用如图1装置制备碳酸亚铁:
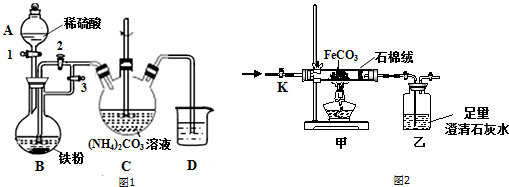
①装置中仪器A的名称为___.实验时要配制100mL 4mol•L-1 H2SO4溶液,需用98%(ρ=1.84g•cm-3)的浓硫酸体积为___.
②制备FeCO3时,将B中混合溶液压入装置C的操作是___.
(2)探究碳酸亚铁性质:
如图2,称取一定质量的纯净FeCO3放入硬质玻璃管中,打开K,通入氧气,加热硬质玻璃管.乙瓶中澄清石灰水不再产生沉淀时(CO32-全部转化为CO2),停止加热,继续通入氧气至玻璃管冷却,称量剩余固体的质量.
①为确定剩余固体中是否含有Fe2+,除稀硫酸外,还需要选用的试剂是___.
②若开始时称取23.2g FeCO3固体,反应后称得剩余固体质量净减7.2g.通过计算确定剩余固体成分是___,写出硬质玻璃管中发生反应的化学方程式___.
(3)FeCO3可用于乳制品、营养液成分乳酸亚铁的制备:将FeCO3加入乳酸溶液中,再加入铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
①反应后加入适量乳酸的作用是___.最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得乳酸亚铁晶体.分离过程中加入无水乙醇的目的是___.
②已知人体不能很好地吸收利用Fe3+,科学研究表明服用含乳酸亚铁的补血剂时,同时服用维生素C,有利于铁元素的吸收.维生素C在这一过程中的作用是___.
(1)利用如图1装置制备碳酸亚铁:

①装置中仪器A的名称为___.实验时要配制100mL 4mol•L-1 H2SO4溶液,需用98%(ρ=1.84g•cm-3)的浓硫酸体积为___.
②制备FeCO3时,将B中混合溶液压入装置C的操作是___.
(2)探究碳酸亚铁性质:
如图2,称取一定质量的纯净FeCO3放入硬质玻璃管中,打开K,通入氧气,加热硬质玻璃管.乙瓶中澄清石灰水不再产生沉淀时(CO32-全部转化为CO2),停止加热,继续通入氧气至玻璃管冷却,称量剩余固体的质量.
①为确定剩余固体中是否含有Fe2+,除稀硫酸外,还需要选用的试剂是___.
②若开始时称取23.2g FeCO3固体,反应后称得剩余固体质量净减7.2g.通过计算确定剩余固体成分是___,写出硬质玻璃管中发生反应的化学方程式___.
(3)FeCO3可用于乳制品、营养液成分乳酸亚铁的制备:将FeCO3加入乳酸溶液中,再加入铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
①反应后加入适量乳酸的作用是___.最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得乳酸亚铁晶体.分离过程中加入无水乙醇的目的是___.
②已知人体不能很好地吸收利用Fe3+,科学研究表明服用含乳酸亚铁的补血剂时,同时服用维生素C,有利于铁元素的吸收.维生素C在这一过程中的作用是___.
▼优质解答
答案和解析
(1)①由仪器A的结构特征,可知A为分液漏斗,根据c=
可知,浓硫酸物质的量浓度为
mol/L=18.4mol/L,根据稀释定律,需要浓硫酸的体积为
=21.7mL,
故答案为:分液漏斗;21.7mL;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,C装置中FeSO4和NH4HCO3发生反应:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2,
故答案为:关闭活塞3,打开活塞2;
(2)①利用硫酸溶解加热后的固体,再滴入酸性高锰酸钾溶液检验,若溶液紫色脱去,说明含有Fe2+,否则不含Fe2+,
故答案为:酸性高锰酸钾溶液;
②23.2g FeCO3物质的量为
=0.2mol,完全分解可以得到二氧化碳为2mol×44g/mol=8.8g,反应中通入氧气,分解得到的FeO会被氧化,剩余固体中Fe为0.2mol,则剩余固体中O元素物质的量为
=0.3mol,故Fe、O物质的量之比为2:3,则剩余固体为Fe2O3,反应方程式为:4FeCO3+O2
2Fe2O3+4CO2,
故答案为:Fe2O3;4FeCO3+O2
2Fe2O3+4CO2;
(3)①Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,且抑制Fe2+的水解,
分离过程中加入无水乙醇,减少乳酸亚铁在水中的溶解量,有利于晶体析出,
故答案为:除去过量铁粉,且抑制Fe2+的水解;减少乳酸亚铁在水中的溶解量,有利于晶体析出;
②维生素作还原剂,防止Fe2+被氧化,
故答案为:作还原剂,防止Fe2+被氧化.
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 100mL×4mol/L |
| 18.4mol/L |
故答案为:分液漏斗;21.7mL;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,C装置中FeSO4和NH4HCO3发生反应:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2,
故答案为:关闭活塞3,打开活塞2;
(2)①利用硫酸溶解加热后的固体,再滴入酸性高锰酸钾溶液检验,若溶液紫色脱去,说明含有Fe2+,否则不含Fe2+,
故答案为:酸性高锰酸钾溶液;
②23.2g FeCO3物质的量为
| 23.2g |
| 116g/mol |
| 23.2g-7.2g-0.2mol×56g/mol |
| 16g/mol |
| ||
故答案为:Fe2O3;4FeCO3+O2
| ||
(3)①Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,且抑制Fe2+的水解,
分离过程中加入无水乙醇,减少乳酸亚铁在水中的溶解量,有利于晶体析出,
故答案为:除去过量铁粉,且抑制Fe2+的水解;减少乳酸亚铁在水中的溶解量,有利于晶体析出;
②维生素作还原剂,防止Fe2+被氧化,
故答案为:作还原剂,防止Fe2+被氧化.
看了工业上制备补血剂常用碳酸亚铁,...的网友还看了以下:
“天宫一号”是中国第一个目标飞行器,于2011年9月29日晚在捆绑式火箭助推器作用下圆满发射成功, 2020-05-14 …
●若用8位机器码表示十进制整数-127,则其原码表示为(9),补码表示为(10)。(9)A.1000 2020-05-26 …
与方形补偿器相比,填料式补偿器的特点有( )。 A.轴向推力大 B.流体阻力大 C.易漏水 2020-06-07 …
填料式补偿器又称套筒式补偿器,它是由( )三部分组成。 A.带底角的套筒 B.插管 C.填 2020-06-07 …
与方形补偿器相比,填料式补偿器的特点有( )。A.轴向推力大B.流体阻力大C.易漏水漏气D.占地面积 2020-06-07 …
一个容器内原有药占水的1/11,加入15克的药后,药占药水的1/9,现容器内有药多少克?设:水为x 2020-06-18 …
电容补偿器耗电量计算公式及简单计算方法?例如:一台900Kvar的10KV电容补偿器每小时的耗电量 2020-06-27 …
2016年9月15日“天宫二号空间实验室发射任务圆满成功”中国载人航天工程进入崭新时期.其中火箭推 2020-07-08 …
我是2000年9月进入小学的,2006年6月小学毕业,2006年9月进入初中,2009年6月初中毕业 2020-11-04 …
英语翻译敬启者感谢你方9月10日购买印花布的订单,但遗憾的是我方无法接受.因为自从8月15日我们向你 2020-11-28 …