早教吧作业答案频道 -->化学-->
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:请回答下列问题:(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
题目详情
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
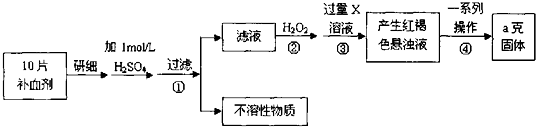
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:___.
(2)步骤②加入过量H2O2的目的是___.
(3)步骤③中反应的离子方程式___.
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量___g.
(6)该小组有些同学认为将KMnO4溶液滴入滤液也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是___.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.浓硝酸
③恰好反应完时的溶液颜色为___色.
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天服用___mgFeSO4•7H2O的片剂.

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:___.
(2)步骤②加入过量H2O2的目的是___.
(3)步骤③中反应的离子方程式___.
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量___g.
(6)该小组有些同学认为将KMnO4溶液滴入滤液也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是___.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.浓硝酸
③恰好反应完时的溶液颜色为___色.
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天服用___mgFeSO4•7H2O的片剂.
▼优质解答
答案和解析
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-⇌Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤、干燥得到氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤、干燥;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选B,
故答案为:B;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:紫;
(7)正常人每天应补充14mg左右的铁,则每天约需要服用含FeSO4•7H2O的质量=
×100%=69.5mg,
故答案为:69.5mg;
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-⇌Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤、干燥得到氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤、干燥;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
| ||
| 10 |
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选B,
故答案为:B;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:紫;
(7)正常人每天应补充14mg左右的铁,则每天约需要服用含FeSO4•7H2O的质量=
| 14mg | ||
|
故答案为:69.5mg;
看了硫酸亚铁晶体(FeSO4•7H...的网友还看了以下:
硫酸铜晶体里结晶水含量的测定,实验步骤为、、加热、称量、、计算,其中在加热这一步操作中,应注意用酒 2020-05-13 …
问一个关于高锰酸钾的问题~某同学想用实验证明高锰酸钾溶液的紫颜色是高锰酸根离子的颜色,而不是钾离子 2020-05-14 …
联合制氨法中析出副产品氯化铵这一步具体怎么实现联合制氨法的步骤:1.将二氧化碳通入氨的氯化钠饱和溶 2020-05-17 …
铁粉、铜粉混合物样品11.6g,逐步加入2.0mol/L,的硫酸溶液,充分反应后剩余固体质量随加入 2020-06-14 …
将某温度下的硝酸钾溶液200克蒸发掉10克水,恢复到原温度,或向其中加入10克硝酸钾固体,均达到饱 2020-06-27 …
某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液.实验方 2020-07-08 …
(10)按要求完成硝酸钾晶体的制备实验:步骤操作具体操作步骤现象解释结论等①溶解取20克NaNO3 2020-07-10 …
实验室用稀硝酸与铜反应制备硝酸铜晶体及NO气体,需经过铜与稀硝酸反应、收集NO、尾气处理、制取硝酸 2020-07-20 …
三草酸合铁(Ⅲ)酸钾晶体(Kx[Fey(C2O4)Z]•nH2O)可用于摄影,为确定其组成进行如下 2020-07-25 …
现有碳酸氢钠固体(俗名小苏打)y混入了少量的碳酸镁固体,小明同学为了测定其y碳酸氢钠的百分含量,实验 2020-12-25 …