早教吧作业答案频道 -->化学-->
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:(1)查阅资料:无水亚硫
题目详情
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
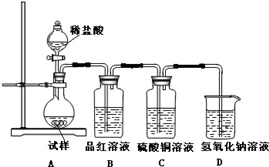
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为___;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为___;此时在B、C两装置中可能观察到的现象为___.
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是___(填“甲”或“乙”),请说明另一方案不合理的原 因___.
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式___.

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为___;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为___;此时在B、C两装置中可能观察到的现象为___.
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),你认为合理的方案是___(填“甲”或“乙”),请说明另一方案不合理的原 因___.
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式___.
▼优质解答
答案和解析
(1)Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3,向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:先逐渐增大,后逐渐减小;
(2)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象,B中无明显变化,C中产生黑色沉淀;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化.(或答“B中无明显变化,C中产生黑色沉淀”);
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子(SO42-),确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子,甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-,
故答案为:乙; 甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-;
(5)依据上述分析判断,亚硫酸钠加热到600℃以上分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3Na2S+3Na2SO4,
故答案为:4Na2SO3
Na2S+3Na2SO4.
故答案为:先逐渐增大,后逐渐减小;
(2)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象,B中无明显变化,C中产生黑色沉淀;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化.(或答“B中无明显变化,C中产生黑色沉淀”);
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子(SO42-),确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子,甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-,
故答案为:乙; 甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-;
(5)依据上述分析判断,亚硫酸钠加热到600℃以上分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3Na2S+3Na2SO4,
故答案为:4Na2SO3
| ||
看了为探究亚硫酸钠的热稳定性,某研...的网友还看了以下:
断路器的技术特性数据中,电流绝对值最大的是()。A.额定电流B.额定开断电流C.额定热稳定电流D.动 2020-05-29 …
雨生红球藻是绿藻,含天然虾青素,已成为近年来国际上天然虾青素生产的研究热点.为了培养雨生红球藻以获 2020-07-01 …
(1)热敏电阻是传感电路中常用的电子元件.现用伏安法研究热敏电阻在不同温度下的伏安特性曲线,要求特 2020-07-11 …
燃气热水器的额定热功率是16KW/小时因为我不知道额定热功率是什么样的概念所以,我想问一下,这个热 2020-07-29 …
公元1821年,德国物理学家塞贝克发现了在一定条件下,由几个导体串联成的闭合电路中会产生电流.能把这 2020-10-30 …
焦耳测定热功当量实验,焦耳研究了多少年 2020-12-03 …
阅读下面的文字,完成6―7题。生命科学和生物技术的研发在过去一年继续升温,其中,寻找新的干细胞资源和 2020-12-07 …
为什么灯泡亮度与焦耳定律无关,灯泡属于纯电阻电路,它发光是由于产生了热量变的灼热而发光焦耳定律不是决 2020-12-20 …
长为l的均匀杆侧面绝缘一端温度为零另一端有恒定热流q流进杆的初始温度分布为1/2x(l-x)写出相应 2020-12-22 …
(12分)现用伏安法研究热敏电阻在不同温度下的伏安特性曲线要求特性曲线尽可能完整。已知常温下待测热敏 2020-12-31 …